- Kupfer(II)-tartrat
-
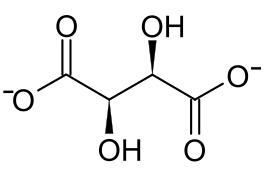
Strukturformel 
wasserfreies Kupfer(II)-tartrat der L-Weinsäure Allgemeines Name Kupfer(II)-tartrat Andere Namen - IUPAC: Kupfer(II)-bis(2,3-dihydroxybutandioat)
- Weinsäure Kupfer(II)-salz
Summenformel C4H4CuO6 CAS-Nummer - 815-82-7 (wasserfrei)
- 946843-80-7 (Hydrat)
- 5893-71-0 (Trihydrat)
PubChem 16213749 Kurzbeschreibung grüner bis blauer Feststoff (Hydrat)[1]
Eigenschaften Molare Masse 211,62 g·mol−1 (wasserfrei) Aggregatzustand fest
Löslichkeit wenig in Wasser löslich[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] keine GHS-Piktogramme H- und P-Sätze H: keine H-Sätze EUH: keine EUH-Sätze P: keine P-Sätze EU-Gefahrstoffkennzeichnung [3] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: (1/2)-22 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Als Kupfer(II)-tartrat bezeichnet man das Kupfer(II)-Salz der Weinsäure. Resultierend aus der Stereochemie der Weinsäure existieren drei Stereoisomere. Das sind das Enantiomerenpaar Kupfer(II)-L-tartrat und Kupfer(II)-D-tartrat, sowie das Kupfer(II)-meso-tartrat. Es handelt sich um bläuliche Kristalle oder Pulver, die als Komplexverbindungen vorliegen.[4] Die Salze besitzen eine 1:1-Stöchiometrie hinsichtlich der Kupfer- und Tartrationen mit CuC4H4O6.[4][5][6][7] In wäßriger Lösung existieren noch Kupfer-Tartrat-Komplexe mit einer Stöchiometrie von 1:2 bis 1:6.[8] Das Nachweisreagenz der Fehling-Probe enthält ebenfalls einen Kupfer-Tartrat-Komplex.
Inhaltsverzeichnis
Geschichte
Johann Rudolph Glauber entdeckte Kupfer(II)-tartrat und beschrieb es erstmals.
Darstellung
Die Herstellung der Kupfer(II)-tartrate erfolgt durch die Umsetzung von Kupfer(II)-Salzen mit der entsprechenden Weinsäure. Kupfer(II)-L-tartrat kann durch eine Fällung aus wäßriger Kupfer(II)-acetat-Lösung mit L-Weinsäure erhalten werden.[6] Die Herstellung gelingt auch aus Kupfer(II)-chlorid-Lösungen.[7] Kupfer-II-D-tartrat und Kupfer-II-meso-tartrat wurden durch langsame Verdampfungskristallisation aus Lösungen aus basischen Kupfer(II)-carbonat und D- bzw. meso-Weinsäure gewonnen.[5] Alle Salze fallen dabei als Trihydrate an. Ein hydratwasserfreies Salz kann aus Dinatriumtartrat- und Kupfer-II-chloridlösungen erhalten werden. Der durch Erhitzen am Wasserbad gewonnene Niederschlag wird im Exsikkator über trockenem Calciumchlorid aufbewahrt.[9]
Industriell wird es in geringen Mengen aus Weinstein (Kaliumhydrogentartrat) mit Natronlauge und Kupfersulfat gewonnen.Eigenschaften
Physikalische Eigenschaften
Alle Kupfer(II)-Tartrate liegen bei Raumtemperatur als Trihydrate vor. Einkristalluntersuchungen ergaben für das Kupfer(II)-meso-tartrat-Trihydrat ein orthorhombisches, für das Kupfer(II)-D-tartrat-Trihydrat ein monoklines Kristallgitter.[5] Für das Kupfer(II)-L-tartrat-Trihydrat wurde ein orthorhombisches Kristallgitter gefunden.[7] Da das L- und D-Tartrat ein Enantiomerenpaar darstellt, sollten für beide Stereoisomere eine orthorhombische und eine monokline, polymorphe Kristallstruktur möglich sein. Mittels Röntgenbeugungs-Einkristalluntersuchungen konnte eine polymere Komplexstruktur [Cu2(C4H4O6)2(H2O)2]·4H2O}∞ festgestellt werden, in der jedes Kupfer(II)-ion oktaedrisch mit sechs Sauerstoffatomen jeweils von einem Wassermolekül und drei Tartrationen koordiniert ist. Die beiden Tartrationen in der [Cu2(C4H4O6)2(H2O)2]-Komplexstruktur haben eine unterschiedliche Koordination zu den Kupferionen, eines ist mit fünf Tartratsauerstoffatomen, das andere mit sechs Tartratsauerstoffatomen gebunden.[4]
Die Kupfer(II)-tartrate sind gut in Wasser löslich und ergeben deutlich blau gefärbte wässrige Lösungen.
In wässrigen Lösungen können Kupfer(II)-tartrat-Komplexe mit verschiedener Stöchiometrie vorliegen. Das Kupfer-Ion wird dabei von einem bis sechs Tartrat-Ionen umgeben, die sich jeweils mit der Carboxygruppe zum Kupfer orientieren.[8]Chemische Eigenschaften
Kupfer(II)-tartrat reagiert mit einigen organischen Reagenzien als Oxidationsmittel. Dabei wird das Kupfer(II)-Ion zum Kupfer(I)-Ion reduziert. Im Beisein von Hydroxid-Ionen können zum Beispiel Aldehyde selektiv oxidiert werden. Durch die Komplexbildung mit Tartrat wird hierbei die Ausfällung von Kupfer(II)-hydroxid verhindert, das die Reaktion stören würde. Aus dem Kupfer(I)-Ion entsteht rotes Kupfer(I)-oxid:


- Reaktion mit Aldehyden
Beim Erhitzen in der Thermowaage wird ab 200 °C ein Massenabbbau beobachtet. Der Rückstand besteht aus Kupfer(I)-oxid.[9]
Verwendung
Verwendet wird Kupfer(II)-tartrat in Verbindung mit Natronlauge in der organischen Chemie, um Aldehyde oder reduzierende Zucker nachzuweisen (Fehling-Probe über Bildung alkalischer Kupfertartratlösung) oder um Formaldehyd in Gaswaschflaschen zu absorbieren. Dieses wird zu Ameisensäure oxidiert und ist damit nicht mehr giftig:

- Oxidation von Formaldehyd
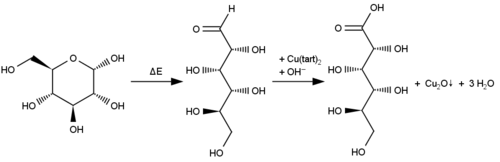
- Nachweis von D-Glucose über Oxidation
Kupfer(II)-tartrat ist ein ähnlich mildes Oxidationsmittel wie Silber(I)-diammin. Eine Thermolyse von Mischkristallen aus Kupfer(II)-tartrat und Zink(II)-tartrat ergibt für die Methanolsynthese aus Synthesegas relevante Kupfer/Zinkoxid-Katalysatoren.[6]
Einzelnachweise
- ↑ a b Sicherheitsdatenblatt Strem
- ↑ Datenblatt Copper(II) tartrate hydrate bei Sigma-Aldrich, abgerufen am 7. April 2011.
- ↑ http://www.lohmann-chemikalien.de/as/de,0,kupfer(ii)-tartrat,1__de-produktsuche_detail.htm?from=reg
- ↑ a b c Jian, Fangfang; Zhao, Pusu; Wang, Qingxiang: Synthesis and crystal structure of a novel tartrate copper(II) two-dimensional coordination polymer: {[Cu2(C4H4O6)2(H2O)2]·4H2O}∞ in J. Coord. Chem. 58 (2005) 1133-1138. doi:10.1080/00958970500148446
- ↑ a b c C. K. Prout, J. R. Carruthers, F. J. C. Rossotti: Structure and stability of carboxylate complexes. Part VII. Crystal and molecular structures of copper(II)meso-tartrate trihydrate and copper(II)d-tartrate trihydrate in J. Chem. Soc. A, Inorg. Phys. Theo., 1971, 3336 - 3342. doi:10.1039/J19710003336
- ↑ a b c R. Weiss, S. Vukojevi, C. Baltes, R. Naumann d'Alnoncourt, M. Muhler, M. Epple: Copper/Zinc L-Tartrates: Mixed Crystals and Thermolysis to a Mixture of Copper Oxide and Zinc Oxide That Is Catalytically Active in Methanol Synthesis in Eur. J. Inorg. Chem. 2006, 4782-4786. doi:10.1002/ejic.200600561
- ↑ a b c I. Quasima A. Firdous, B. Want, S.K. Khosa and P.N. Kotru: Single crystal growth and characterization of pure and sodium-modified copper tartrate in J. Cryst. Growth 310 (2008) 5357-5363. doi:10.1016/j.jcrysgro.2008.09.021
- ↑ a b N.D. Jespersen: Novel Copper-Tartrate Coordination Compounds in Anal. Let. 5 (1972) 497-508.
- ↑ a b E.C. Rodrigues, C.T. Carvalho, A.B. de Siqueira, G. Bannach, M. Ionashiro: Synthesis, characterization and thermal behaviour on solid tartrates of some bivalent metal ions in Thermochim. Acta 496 (2009) 156–160.doi:10.1016/j.tca.2009.07.015
Literatur
- Heinz G. O. Becker, et al.: Organikum. 22. Auflage. Wiley-VCH, Weinheim 2004, ISBN 3-527-31148-3.
Wikimedia Foundation.
