- 1,2-Dibromethan
-
Strukturformel 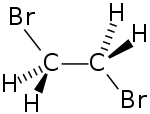
Allgemeines Name 1,2-Dibromethan Andere Namen Ethylendibromid
Summenformel C2H4Br2 CAS-Nummer 106-93-4 PubChem 7839 Kurzbeschreibung farblose bis gelbliche Flüssigkeit mit phenolartigem Geruch[1]
Eigenschaften Molare Masse 187,86 g·mol−1 Aggregatzustand flüssig
Dichte 2,18 g·cm−3[1]
Schmelzpunkt Siedepunkt 131 °C[1]
Dampfdruck Löslichkeit - 5,3 g·l−1 in Wasser (30 °C)[1]
- löslich in Diethylether und Ethanol[2]
Brechungsindex 1,539 (20 °C)[3]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 


Gefahr
H- und P-Sätze H: 301-311-331-350-315-319-335-411 EUH: keine EUH-Sätze P: 201-273-309-310 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 45-23/24/25-36/37/38-51/53 S: 53-45-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C 1,2-Dibromethan ist eine farblose giftige Flüssigkeit, die ähnlich wie Chloroform riecht und hauptsächlich als Lösungsmittel, zur Containerbegasung und als Synthese-Zwischenprodukt Verwendung findet.
Inhaltsverzeichnis
Gewinnung und Darstellung
1,2-Dibromethan kann durch direkte Bromierung von Ethen (also durch eine klassische Halogen Additionsreaktion) oder durch Reaktion von Bromwasserstoffsäure mit Ethin hergestellt werden.
Eigenschaften
Dibromethan ist eine brennbare, farblose bis gelbliche Flüssigkeit mit phenolartigem Geruch. Bei Normaldruck siedet die Verbindung bei 131 °C.[1] Die Verdampfungsenthalpie beträgt hier 41,78 kJ·mol-1.[5] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 7,36914, B = 4101,146 und C = 153,034 im Temperaturbereich von 246 K bis 405 K.[6] Dämpfe von Dibromethan sind sechsmal schwerer als Luft. In fester Phase können zwei polymorphe Kristallformen vorliegen. Der Umwandlungspunkt der Tieftemperaturform II zur Hochtemperaturform I liegt bei -23 °C.[7][8] Die Umwandlungsenthalpie dieses Festphasenübergangs beträgt 1,94 kJ·mol-1.[8] Beide Formen stehen enantiotrop zueinander. Die Kristallform I zeigt bei 10 °C einen Schmelzpunkt mit einer Schmelzenthalpie von 10,94 kJ·mol-1.[8] Der Tripelpunkt liegt bei 10 °C[8] und 9,2 mbar[9]. Dibromethan zersetzt sich langsam im Sonnenlicht, ansonsten ist die Verbindung stabil.
Verwendung
Die noch in den 1980er Jahren übliche Verwendung von 1,2-Dibromethan als Zusatz (Scavenger) in verbleitem Treibstoff (zur Vermeidung von Bleirückständen im Motor) wurde wegen seiner Giftigkeit in den Industrieländern eingestellt.
Sicherheitshinweise
1,2-Dibromethan verursacht starke Haut- und Schleimhautreizungen und wird durch die Haut resorbiert. Es ruft Kopfschmerzen, Erbrechen, Harnvergiftung, Leber- und Nierenschäden hervor. Außerdem ist es ein Carzinogen, dass es für den Menschen ein zu beachtendes Risiko darstellt und in der MAK der Gruppe III A 2 zugeordnet wurde.[10]
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu 1,2-Dibromethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31.12.2007 (JavaScript erforderlich)
- ↑ Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ Datenblatt 1,2-Dibromethan bei Sigma-Aldrich, abgerufen am 5. März 2011.
- ↑ Eintrag zu CAS-Nr. 106-93-4 im European chemical Substances Information System ESIS
- ↑ Svoboda, V.; Kubes, V.; Basarova, P.: Enthalpies of vaporization and cohesive energies of 1,1,2,2-tetrachloro-1,2-difluoroethane, 1,2-dibromoethane, 1-bromo-2-chloroethane, 1,3-dibromo-propane, and 1,4-dibromo-2,3-dichloro-1,1,2,3,4,4-hexafluorobutane in J. Chem. Thermodyn. 24 (1992) 555-558. doi:10.1016/S0021-9614(05)80125-9
- ↑ Stull, D.R.: Vapor Pressure of Pure Substances Organic Compounds in Ind. Eng. Chem. 39 (1947) 517–540.
- ↑ Railing, W.E.: The specific heat of some ethylene halides in J. Am. Chem. Soc. 61 (1939) 3349-3353. doi:10.1021/ja01267a034
- ↑ a b c d Pitzer, K.S.: The heat capacities, heats of transition and fusion, and entropies of ethylene dichloride and ethylene dibromide in J. Am. Chem. Soc. 62 (1940) 331-335. doi:10.1021/ja01859a028
- ↑ berechnet aus Dampfdruckfunktion
- ↑ Hermann Römpp: Römpp Chemie Lexikon. 9. Auflage. Thieme Georg Verlag, 1995, ISBN 3-13-102759-2. (S. 941)
Kategorien:- Giftiger Stoff
- Krebserzeugender Stoff
- Umweltgefährlicher Stoff
- Bromalkan
Wikimedia Foundation.

