- Natriumhydrogensulfat
-
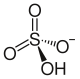
Strukturformel 
Allgemeines Name Natriumhydrogensulfat Andere Namen - primäres Natriumsulfat
- saures Natriumsulfat
- Natriumbisulfat
- pH-Minus (als Schwimmbadzusatz)
Summenformel NaHSO4 CAS-Nummer - 7681-38-1
- 10034-88-5 (Monohydrat)
Kurzbeschreibung weißer, kristalliner Feststoff [1]
Eigenschaften Molare Masse 120,06 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 
Gefahr
H- und P-Sätze H: 318 EUH: keine EUH-Sätze P: 262-305+351+338 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Reizend (Xi) R- und S-Sätze R: 41 S: (2)-24-26 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumhydrogensulfat (NaHSO4) ist ein saures Natriumsalz der Schwefelsäure. Als Anion enthält es das Hydrogensulfat-Ion. Es wird auch als primäres oder saures Natriumsulfat bezeichnet; ein älterer Name ist Natriumbisulfat.
Der weiße, kristalline Feststoff löst sich leicht unter Bildung einer sauren Lösung in Wasser:
Erhitzt man das saure Natriumsulfat, so wandelt es sich unter Abgabe von Wasser (Dehydratisierung) in Natriumdisulfat um:
Bei weiterem Erhitzen zerfällt das Natriumdisulfat in Natriumsulfat und Schwefeltrioxid:
Herstellung
- Die Synthese von Natriumhydrogensulfat gelingt durch Einwirkung mäßig warmer, konzentrierter Schwefelsäure auf Natriumchlorid. Als Nebenprodukt entsteht das Gas Chlorwasserstoff:
- Konzentrierte Schwefelsäure auf Natriumhydroxid tropfen, bis ein Überschuss der Schwefelsäure entsteht. Durch die Wärme entweicht das Wasser. Es bleibt das gewünschte Monohydrat zurück, sofern es nicht zu heiß wird.
- Konzentrierte Schwefelsäure auf Natriumcarbonat oder Natriumhydrogencarbonat tropfen, bis kein Gas mehr entweicht. Das entstehende Wasser muss im Exsikkator entfernt werden. Durch Eindampfen der Lösung entsteht in den meisten Fällen auch Natriumdisulfat. Dieses kann mit Wasser befeuchtet und anschließend im Exsikkator getrocknet werden.
Anwendungen
Natriumhydrogensulfat wird zur Senkung des pH-Wertes in Schwimmbecken verwendet, wenn das Wasser zu alkalisch geworden ist.
In der Lebensmitteltechnologie dient es als Festigungsmittel, Säureregulator und Trägersubstanz. Natriumhydrogensulfat und Natriumsulfat sind in der EU als Lebensmittelzusatzstoff der Nummer E 514 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen.[3]
Links: Probe von Natriumhydrogensulfat. Der Stoff ist stark hygroskopisch, so dass es, wie auf dem Bild zu sehen, zur Bildung von Klumpen kommt, die nur schwer wieder zu zerkleinern sind.
Einzelnachweise
- ↑ a b c d e Eintrag zu CAS-Nr. 7681-38-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 24. Oktober 2007 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 7681-38-1 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ zusatzstoffe-online.de
Kategorien:- Reizender Stoff
- Natriumverbindung
- Sulfat
Wikimedia Foundation.







