- Natriumthiocyanat
-
Strukturformel 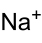

Allgemeines Name Natriumthiocyanat Andere Namen - Natriumrhodanid
- Natriumsulfocyanid
Summenformel NaSCN CAS-Nummer 540-72-7 Kurzbeschreibung farbloser Feststoff [1]
Eigenschaften Molare Masse 81,07 g·mol−1 Aggregatzustand fest
Dichte 1,73 g·cm–3 [1]
Schmelzpunkt Dampfdruck Löslichkeit löslich in Wasser: 1250 g·l−1 (20 °C) [2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [1] 
Achtung
H- und P-Sätze H: 332-312-302-412 EUH: 032 P: 273-280 [1] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20/21/22-32-52/53 S: (2)-13-61 LD50 764 mg·kg−1 (Ratte, oral) [2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumthiocyanat ist eine gesundheitsschädliche chemische Verbindung mit der Formel NaSCN, die bei Raumtemperatur als weißer, hygroskopischer Feststoff vorliegt. Es wird in vielen Synthesen verwendet, die das Thiocyanation (Rhodanid) SCN− benötigen.
Inhaltsverzeichnis
Gewinnung und Darstellung
Die Darstellung von Natriumthiocyanat wird mit Natriumcyanid und elementarem Schwefel durchgeführt:
Eigenschaften
Kristalle von NaSCN sind orthorhombisch, wobei jedes Na+ von drei Schwefel- und drei Stickstoffliganden umgeben ist.[4] Durch starke Säuren wird aus NaSCN Isothiocyansäure (S=C=NH, pKa = −1,28) freigesetzt.[5]
Verwendung
Verwendung findet NaSCN bei der Umwandlung von Halogenalkanen in entsprechende Alkylthiocyanate, wobei auch Kaliumthiocyanat und seltener Ammoniumthiocyanat eingesetzt werden können. Beispiele für derartige Synthesen sind die Herstellung von Isopropylthiocyanat aus Isopropylbromid mit NaSCN in heißem Ethanol.[6] Zur Herstellung von Thioharnstoff wird aus NaSCN das instabile HSCN in situ erzeugt, welches dann mit organischen Aminen Thioharnstoffverbindungen bildet.[7] Wie die beiden anderen erwähnten Thiocyanate (von K+ und NH4+) wird NaSCN in der Phototechnik (Sensibilisierung), Galvanotechnik (Glanzbildner für Kupferbäder), Metallurgie (Extraktion von Zirconium, Hafnium und Lanthanoiden), Textilindustrie (Färbehilfsmittel, Bedrucken), chemischen Industrie und Analytik (Produktion von Herbiziden und Fungiziden, Fe3+-Nachweis) verwendet.
Gefahrenhinweise
Natriumthiocyanat ist als mindergiftig eingestuft, d. h. gesundheitsschädlich beim Verschlucken und bei Berührung mit der Haut, allerdings entwickelt es bei Kontakt mit Säure sehr giftige Gase. Das krebserzeugende und wassergefährdende Potential von NaSCN ist als relativ gering zu bewerten.
Einzelnachweise
- ↑ a b c d e Eintrag zu Natriumthiocyanat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Feb. 2008 (JavaScript erforderlich)
- ↑ a b c Datenblatt Natriumthiocyanat bei Merck, abgerufen am 10. August 2010.
- ↑ Eintrag zu CAS-Nr. 540-72-7 im European chemical Substances Information System ESIS
- ↑ P. H. van Rooyen, J. C. A. Boeyens: Sodium thiocyanate. In: Acta Crystallographica. 1975, B31, S. 2933-2934.
- ↑ Y. Chiang, A.J. Kresge: Determination of the Acidity Constant of Isothiocyanic Acid in Aqueous Solution. In: Canadian Journal of Chemistry. 2000, 78, S. 1627-1628.
- ↑ R. L. Shriner: Isopropyl Thiocyanate. In: Organic Syntheses. 1943, 2, S. 366 (pdf)
- ↑ C. F. H. Allen, J. VanAllan: 2-Amino-6-Methylbenzothiazole. In: Organic Syntheses. 1955, 3, S. 76. ([http://www.orgsyn.org/orgsyn/pdfs/CV3P0076.pdf pdf).
Literatur
- Holleman, Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Berlin, New York: De Gruyter 1995, ISBN 3-11-01-2641-9.
Wikimedia Foundation.

