- Lassaignesche Probe
-
Der Natrium-Aufschluss ist der Aufschluss meist organischer Substanzen mit elementarem Natrium unter starkem Erhitzen. Hierbei werden bestimmte Elemente der organischen Substanz in leicht lösliche Natriumsalze überführt. Die Untersuchung dieser Salze ermöglicht den Nachweis von Stickstoff, Schwefel und Halogenen in der ursprünglichen Substanz, weswegen der Natrium-Aufschluss zur Elementaranalyse in der qualitativen organischen Analyse Anwendung findet.
Inhaltsverzeichnis
Schema des Aufschlusses
Das Schema des Natrium-Aufschlusses lautet:
-
-
- (organische Substanz) H, C, N, S, Hal
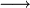 NaCN, Na2S, NaSCN, NaHal (aufgeschlossene Substanz)
NaCN, Na2S, NaSCN, NaHal (aufgeschlossene Substanz)
- (organische Substanz) H, C, N, S, Hal
-
Es entstehen also die Natriumsalze-
- Natriumcyanid NaCN, wenn Stickstoff in der Substanz enthalten war,
- Natriumsulfid Na2S, wenn Schwefel enthalten war,
- Natriumthiocyanat NaSCN, wenn Stickstoff und Schwefel enthalten waren (selten),
- Natriumhalogenid(e) NaHal, wenn Halogen(e) enthalten war(en).
Weiterhin verbrennen bei der Hitze Kohlenstoff und Wasserstoff zu Kohlendioxid und Wasser, welche schnell entweichen.Durchführung
Etwas organische Substanz wird in ein Glühröhrchen gegeben, dann wird ein frisch geschnittenes Stückchen Natrium in den Hals des Glühröhrchens gelegt. Nun wird das Röhrchen mit spitzer Flamme dort erhitzt, wo das Natrium-Stück aufliegt. Das Natrium schmilzt und fließt heiß in die organische Substanz. Es tritt eine oft heftige Reaktion ein. Sobald die Reaktion etwas abklingt, wird das Glühröhrchen mit einer Bunsenbrennerflamme zur Rotglut erhitzt. Noch heiß wird es in ca. 5 - 10 ml dest. Wasser gebracht (Vorsicht! Heftig!). Das Röhrchen platzt und die entstandenen Salze gehen in Lösung. Das zersprungene Glas und Ruß-Rückstände werden abfiltriert und man erhält eine klare, stark alkalische Lösung der Natriumsalze.
Problem: Leicht flüchtige Substanzen verdampfen, bevor sie mit Natrium umgesetzt werden. Dementsprechend eignen sich solche Substanzen nicht für die Elementaranalyse durch Natrium-Aufschluss.
Mit halogenierten Kohlenwasserstoffen oder Nitroverbindungen kann es beim Natriumaufschluss zu heftigen Explosionen kommen. Daher darf nur mit kleinen Substanzmengen gearbeitet werden; die Sicherheitsvorschriften sind zu beachten.
Nachweise
Bei allen Nachweisen empfiehlt es sich, zusätzliche Blindproben durchzuführen. Dazu kann man entweder zusätzlich Substanzen aufschließen, bei denen man sicher ist, dass sie Stickstoff/Schwefel/Halogene enthalten, oder man verwendet direkt verdünnte Lösungen der Salze, die man nachweisen will.
Der Nachweis von Stickstoff bzw. Natriumcyanid NaCN sollte zuerst erfolgen, da für die anderen Nachweise angesäuert werden muss: Gefahr der Freisetzung von Blausäure HCN (extrem giftig/tödlich!).
Stickstoff-Nachweis
Stickstoff wird mit der Laissagne-Probe nachgewiesen. Wenn Natriumcyanid vorhanden ist, bildet sich Berliner Blau, welches an der charakteristischen blaugrünen Farbe zu erkennen ist. Kann Cyanid nachgewiesen werden, muss die alkalische Lösung zur Trockne eingeengt werden, so dass das Cyanid basisch verkocht wird.
Blindproben: Pyridin oder Anilin (zum Aufschluss), Kaliumcyanid KCN (als Salz)
Schwefel-Nachweis
Schwefel bzw. Sulfid wird durch die Fällung von Bleisulfid nachgewiesen. Etwas von der Aufschluss-Lösung wird mit Essigsäure schwach sauer gemacht, dann wird eine verdünnte Lösung von Blei(II)-acetat zugetropft. Wenn Natriumsulfid Na2S enthalten ist, bildet sich schwarzes Blei(II)-sulfid PbS. Unter Umständen kann sich das Gemisch auch weiß bis gelblich trüben. Dies passiert, wenn zusätzlich Natriumhalogenide NaHal vorhanden sind, die mit Blei(II) Halogenid-Niederschläge bilden.
Blindproben: Toluolsulfonsäure oder versch. Thiole (zum Aufschluss), Schwefelwasserstoff H2S oder Natriumsulfid Na2S (als Salz)
Thiocyanat-Nachweis
Etwas Aufschluss-Lösung wird neutralisiert und eine verdünnte Fe(III)chlorid-Lösung zugetropft. Wenn Natriumthiocyanat vorhanden ist, bildet sich blutrotes Eisenrhodanid.
Blindprobe: Kaliumthiocyanat KSCN
Halogen-Nachweis (außer Fluor)
Etwas Aufschluss-Lösung wird mit Salpetersäure schwach sauer gemacht, dann wird eine 5%ige Silbernitrat-Lösung zugetropt. Sind Natriumhalogenide NaHal vorhanden, fällt ein Niederschlag von Silberhalogeniden AgHal aus.
Probleme:
- Fluorid kann hierdurch nicht nachgewiesen werden.
- Ist Thiocyanat anwesend, reagiert es als Pseudohalogenid. Es entsteht weißes AgSCN und dies kann Halogene/Halogenide vortäuschen.
- Die Silberhalogenid-Fällung funktioniert mit Thiocyanat, Chlorid, Bromid und Iodid. Welches davon entstanden ist, kann man nur durch einen anorganischen Halogenid-Trennungsgang genau heraus finden.
Generell: AgSCN und AgCl sind farblos und lassen sich mit gesättigter warmer Ammoniumcarbonatlösung wieder auflösen. AgBr und AgI sind gelblich, AgBr löst sich in konz. Ammoniak und AgI nicht. AgI löst sich nur in konz. Natriumthiosulfat-Lösung.
Blindproben: Organische Substanzen enthalten meist Chlor oder Brom, seltener Fluor oder Iod. Blindproben sollten mit Benzylchlorid oder Brombenzol durchgeführt werden (Aufschluss), mit Natriumchlorid NaCl als Salz.
Fluor-Nachweis
Etwas Analysensubstanz wird zur absoluten Trockne eingeengt (Bunsenbrenner-Flamme). Dann wird konz. Schwefelsäure zugegeben. Ist Natriumfluorid anwesend, bildet sich Fluorwasserstoff HF, welcher die Glaswände des Reagenzglases ätzt. Das erkennt man daran, wie das Gemisch an der Glaswand abfließt.
Blindprobe: Hier ist eine Blindprobe unbedingt erforderlich, z.B. mit Natriumfluorid NaF.
-
Wikimedia Foundation.
