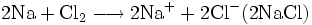- Oxidieren
-
Die Oxidation (oder Oxydation) ist eine chemische Reaktion, bei der ein zu oxidierender Stoff (Elektronendonator) Elektronen abgibt.[1] Ein anderer Stoff (Oxidationsmittel) nimmt die Elektronen auf (Elektronenakzeptor) und wird dadurch reduziert. Mit der Oxidation ist also immer auch eine Reduktion verbunden. Beide Reaktionen zusammen werden als Teilreaktionen einer Redoxreaktion betrachtet.
- Oxidation:
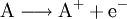
- Stoff A gibt ein Elektron ab.
- Reduktion:
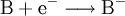
- Das Elektron wird von Stoff B aufgenommen.
- Redoxreaktion:
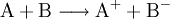
- Stoff A gibt ein Elektron an Stoff B ab.
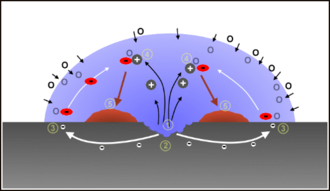 Schematische Darstellung der Bildung von Rost (braun) auf Eisen (grau) in Gegenwart von Wasser (blau) und Sauerstoff (hellblaue Tönung) als Redoxreaktion zwischen Eisen und gelöstem Luftsauerstoff
Schematische Darstellung der Bildung von Rost (braun) auf Eisen (grau) in Gegenwart von Wasser (blau) und Sauerstoff (hellblaue Tönung) als Redoxreaktion zwischen Eisen und gelöstem LuftsauerstoffInhaltsverzeichnis
Geschichte
Der Begriff Oxidation wurde ursprünglich von Antoine Laurent de Lavoisier geprägt, der damit die Vereinigung von Elementen und chemischen Verbindungen mit dem Element Sauerstoff (Oxygenium franz: oxygene), also die Bildung von Oxiden beschreiben wollte. Später erfolgte eine Erweiterung des Begriffes, indem man Reaktionen, bei denen Wasserstoff-Atome einer Verbindung entzogen wurden (Dehydrierung), mit einbezog. Auf Grundlage der Ionentheorie und des Bohrschen Atommodells konnte die Oxidation schließlich unter elektronentheoretischen Gesichtspunkten interpretiert und verallgemeinert werden. Das Charakteristische an diesem Vorgang wird nun in der Elektronenabgabe eines chemischen Stoffes gesehen. Früher wurde die Oxidation als Calzination bezeichnet.
Oxidation durch Sauerstoff
 an der Luft oxidierte Vanadiumspäne, die unter Volumenzunahme im oberen Glas in das schwarze Divanadiumtrioxid übergegangen sind
an der Luft oxidierte Vanadiumspäne, die unter Volumenzunahme im oberen Glas in das schwarze Divanadiumtrioxid übergegangen sindUrsprüngliche Bedeutung und Erweiterung des Begriffs
Als Oxidation im ursprünglichen Sinn bezeichnete man früher die chemische Reaktion eines Stoffes mit Sauerstoff. Aber auch heute noch assoziiert man mit diesem Begriff vielfach die Umsetzung mit Sauerstoff und die Bildung von Oxiden. Jedoch ist im Rahmen der allgemeineren Definition diese Reaktion nur eine von vielen, die sich mit Hilfe der Valenzelektronentheorie erklären lässt.
Reagiert z. B. ein Metallatom mit einem Sauerstoff-Atom, so kann man die Oxidation des Metalls und somit die Metalloxidbildung anhand folgender Reaktionsgleichungen nachvollziehen:
- Oxidation:
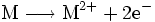
- Oxidation: Das Metall M gibt zwei Elektronen ab.
- Reduktion:
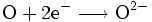
- Sauerstoff (O) nimmt zwei Elektronen auf.
- Redoxreaktion:
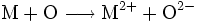
- Sauerstoff oxidiert das Metall und wird dabei selbst reduziert.
Sauerstoff hat in diesem Fall die Tendenz, durch Aufnahme von zwei Elektronen eine stabile Valenzelektronenschale mit insgesamt acht Elektronen aufzubauen (Oktettregel). Das Metall wiederum kann durch Abgabe der Elektronen teilbesetzte Schalen auflösen und so die nächst niedrigere stabile Elektronenkonfiguration erreichen.
Beispiele der Oxidation durch Sauerstoff
Klassische Beispiele für die Oxidation durch Sauerstoff sind alle Arten der Verbrennung von kohlenstoffhaltigen Stoffen unter Luftsauerstoff, z. B. Verbrennung von Kohle, Holz, Benzin im Motor, Kerzen usw. Ausgehend von Kohle (reiner Kohlenstoff) gibt jedes Kohlenstoff-Atom vier Elektronen an zwei Sauerstoff-Atome zur Ausbildung von zwei Doppelbindungen ab. Es entsteht Kohlendioxid (CO2).
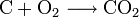
- Kohlenstoff + Sauerstoff → Kohlenstoffdioxid
Nahrung wird im Körper in den vielen Schritten des biochemischen Stoffwechsels u. a. zu körpereigenen Stoffen, Kohlenstoffdioxid (CO2) und Wasser oxidiert. Ein Beispiel ist die β-Oxidation von Fettsäuren. Nicht nur in vivo, auch in vitro können organische Stoffe auf vielfältige Weise mit Sauerstoff reagieren: Ein primärer Alkohol (Alkanol) wird sanft oxidiert. Dabei entsteht zunächst ein Aldehyd (Alkanal), bei nochmaliger Oxidation eine Carbonsäure (Alkansäure). Bei energischerer Oxidation kann der Schritt zum Aldehyd übersprungen werden. Wird ein sekundärer Alkohol oxidiert, so bildet sich dabei ein Keton (Alkanon). Tertiäre Alkohole können auf Grund ihrer bereits vorhandenen drei C-Bindungen nicht oxidiert werden.
Eisen rostet (korrodiert) unter dem Einfluss von Sauerstoff und bildet verschiedene Eisenoxide (Rost, Fe2O3, Fe3O4, FeO).
Bei der Reaktion von Wasserstoff mit Sauerstoff (Knallgas) entsteht Wasserstoffoxid, besser bekannt als Wasser (H2O):
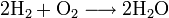
- Wasserstoff + Sauerstoff → Wasser
Oxidation ohne Sauerstoff
Der Begriff der Oxidation wurde später auf Reaktionen erweitert, die nach dem gleichen chemischen Prinzip ablaufen, auch wenn kein Sauerstoff daran beteiligt ist. Im weiteren Sinne bedeutet Oxidation das Abgeben von Elektronen. Zum Beispiel gibt bei der Reaktion von Natrium und Chlor zu Natriumchlorid das Natriumatom ein Elektron an das Chloratom ab, Natrium wird also oxidiert. Im Gegenzug wird Chlor dabei reduziert.
- Teilreaktion Oxidation
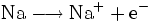
- Natrium gibt ein Elektron ab.
- Teilreaktion Reduktion
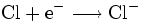
- Im Gegenzug wird Chlor durch Aufnahme eines Elektrons reduziert.
- Gesamtreaktion
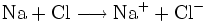
- Natrium und Chlor reagieren in einer Redoxreaktion miteinander.
Da Chlor nur molekular als Cl2 in die Reaktion eingeht, schreibt man genauer
Oxidationszahl
Die Oxidationszahl wird als hypothetische Ladungszahl eines Atoms oder einer Atomgruppe (Molekül) definiert. Bei der Oxidation wird die Oxidationszahl erhöht (Na0 → Na+I), bei der Reduktion verringert.
Bei einem Molekül wird/werden das/die bindende(n) Elektronenpaar(e) dem Atom zugesprochen, dessen Elektronegativität höher ist. Zahlen gleichartiger Atomverbindungen werden untereinander gleich aufgeteilt. Ionen haben als Summe ihrer Oxidationszahlen ihre Ladungszahl, Moleküle die Summe 0. Bedeutend sind die Oxidationszahlen jener Atome, die Bestandteil einer funktionellen Gruppe sind.
Oxidation in der Biologie
Die Oxidation ist nicht zwangsläufig mit einer vollständigen Abgabe von Elektronen und damit der Ionisation der beteiligten Stoffe verbunden – insbesondere in der Organischen Chemie und Biochemie.
Vor allem hier, in der Biologie und Biochemie, definiert man Oxidation NICHT als „Abgabe von Wasserstoff“.
Bei vielen biochemischen Vorgängen in der Zelle, z. B. der Glycolyse, werden organischen Verbindungen Wasserstoffatome durch bestimmte Coenzyme (NAD, NADP, FAD) „entrissen“.
Einzelnachweise
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A.Wilkinson. Blackwell Scientific Publications, Oxford (1997). doi:10.1351/goldbook.O04362
Wikimedia Foundation.