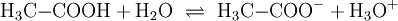- Alkansäure
-
Alkansäuren sind Carbonsäuren, die aus einem Alkylrest und einer Carboxyl-Gruppe aufgebaut sind. Alkansäuren haben die allgemeine Summenformel CnH2n+1COOH (n = 0, 1, 2, 3, ...). Definitionsgemäß verfügt ein Alkylrest weder über aliphatische noch aromatische Doppelbindungen. Verbindungen mit linearen Alkylresten werden auch als gesättigte Carbonsäuren bezeichnet. Alkansäuren mit zwei Carboxyl-Gruppen bezeichnet man als Alkandisäuren und zählt sie zu den Dicarbonsäuren. Die einfachste Alkansäure ist die Methansäure, die unter dem Trivialnamen Ameisensäure bekannt ist. Viele Alkansäuren ab der Butansäure (Buttersäure) zählen zu den gesättigten Fettsäuren.
Inhaltsverzeichnis
Aufbau von Alkansäuren
Alkansäuren bestehen aus der Carboxylgruppe und dem aliphatischen Alkylrest:
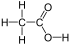
Ethansäure
(= Essigsäure)
n-Hexansäure
(= Capronsäure)Eigenschaften
Die kürzerkettigen Alkansäuren, insbesondere Butansäure, sind stark übelriechende Flüssigkeiten und reagieren in Wasser sauer.
Längerkettige Alkansäuren sind bei Zimmertemperatur weiße Feststoffe. Aufgrund des polaren Charakters der Carboxylgruppe sind die Alkansäuren in der Lage, Wasserstoffbrückenbindungen auszubilden, weswegen sie eine erhöhte Siedetemperatur aufweisen.
All diese Eigenschaften nehmen mit ansteigender Kettenlänge ab, da dann der Einfluss der Carboxylgruppe auf das Gesamtmolekül abnimmt.
Reaktionen
Dissoziation
In Wasser dissoziieren kürzerkettige Alkansäuren (hier Essigsäure):
Das entstehende Säurerest-Ion wird benannt nach dem am Aufbau der Säure beteiligten Alkan und „-oat“ angehängt (teilweise findet sich auch die Endung „-at“), also beispielsweise:
Ethan + „-oat“ : Ethanoat-Ion (auch Acetat-Ion)
Allerdings dissoziieren Alkansäuren nicht vollständig, d. h. nur ein Teil der Alkansäuremoleküle geben ein Wasserstoffion ab. In der Regel sind Alkansäuren also schwache Säuren, was sich in der Säurestärke ausdrückt.
Veresterung
Erwärmt man ein Gemisch aus einer Alkansäure und einem Alkohol im Wasserbad, so findet eine Veresterung statt. Dabei reagiert die OH-Gruppe des Alkohols mit der COOH-Gruppe der Alkansäure und es wird unter Abspaltung von Wasser ein Ester gebildet:

- Ethansäure (Essigsäure) und Ethanol reagieren zu Ethylethanoat (Essigsäureethylester).
Vollständige Oxidation
Alkansäuren werden bei der Verbrennung zu Kohlenstoffdioxid und Wasser oxidiert:
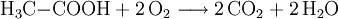
- Ethansäure wird durch Sauerstoff zu Kohlenstoffdioxid und Wasser oxidiert.
Ist das Sauerstoff-Angebot in der Luft nicht ausreichend, entstehen statt Kohlenstoffdioxid Kohlenstoffmonoxid oder Kohlenstoff (in Form von Ruß).
Namen und Formeln von Alkansäuren
Trivialname Chemische Bezeichnung Summenformel Schmelz-
punktSiede-
punktAmeisensäure Methansäure HCOOH 8,4 °C 101 °C Essigsäure Ethansäure CH3COOH 16,7 °C 118 °C Propionsäure Propansäure C2H5COOH −20,8 °C 141 °C Buttersäure Butansäure C3H7COOH −5,5 °C 163 °C Valeriansäure Pentansäure C4H9COOH −34 °C 184–187 °C Capronsäure Hexansäure C5H11COOH −4 °C 206 °C Önanthsäure Heptansäure C6H13COOH −10 °C 222–224 °C Caprylsäure Octansäure C7H15COOH 16,3 °C 237 °C Pelargonsäure Nonansäure C8H17COOH 12,5 °C 255°C Caprinsäure Decansäure C9H19COOH 31,3 °C 268–270 °C Weitere Fettsäuren sind die Palmitinsäure (Hexadecansäure, C15H31COOH) und die Stearinsäure (Octadecansäure, C17H35COOH).
Quellen
- R. Altmann: Chemisch-technische Stoffwerte. Thun; Frankfurt/M. (1987)
AlkansäurenAmeisensäure | Essigsäure | Propionsäure | Buttersäure | Valeriansäure | Capronsäure | Önanthsäure | Caprylsäure | Pelargonsäure | Caprinsäure | Undecansäure | Laurinsäure | Tridecansäure | Myristinsäure | Pentadecansäure | Palmitinsäure | Margarinsäure | Stearinsäure | Nonadecansäure | Arachinsäure | Heneicosansäure | Behensäure | Tricosansäure | Lignocerinsäure | Pentacosansäure | Cerotinsäure | Heptacosansäure | Montansäure | Nonacosansäure | Melissinsäure
Wikimedia Foundation.