- Praziquantel
-
Strukturformel 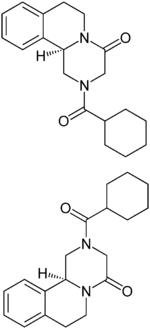
(R)-Enantiomer (oben) und (S)-Enantiomer (unten) Allgemeines Freiname Praziquantel Andere Namen Summenformel C19H24N2O2 CAS-Nummer 55268-74-1 (Racemat) PubChem 4891 ATC-Code P02BA01
DrugBank DB01058 Kurzbeschreibung weißes bis fast weißes, polymorphes, kristallines und hygroskopisches Pulver [1]
Arzneistoffangaben Wirkstoffklasse Verschreibungspflichtig: ja Eigenschaften Molare Masse 312,41 g·mol−1 Schmelzpunkt - 136 °C (racemische Verbindung) [2][3]
- 110 °C (Enantiomere)[2][3]
Löslichkeit - sehr schwer löslich in Wasser (400 mg·l−1) [4]
- leicht löslich in Dichlormethan und Ethanol [1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [5] keine GHS-Piktogramme H- und P-Sätze H: keine H-Sätze EUH: keine EUH-Sätze P: keine P-Sätze EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: 52/53 S: 57-59-60-61 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Praziquantel ist ein Anthelminthikum. Es wirkt gegen Plattwürmer (Plathelminthes) wie Bandwürmer (Cestoda) und Saugwürmer (Trematoda) (einschließlich der Pärchenegel (Schistosoma)). Die durch den Wirkstoff verursachte Öffnung der Calciumkanäle der kontraktilen Zellen der Wurmaußenhaut führt zur spastischen Lähmung des Wurmes und mithin zu dessen Tod und Austreibung mit dem Stuhl bei Innenschmarotzern (Endoparasiten).
Inhaltsverzeichnis
Entwicklungsgeschichte
Praziquantel wurde in den 1970er-Jahren im Rahmen einer Forschungskooperation der Bayer AG mit Merck entwickelt. 1980 wurde das Medikament unter dem Namen Biltricide erstmals vermarktet.[7]
Synthese
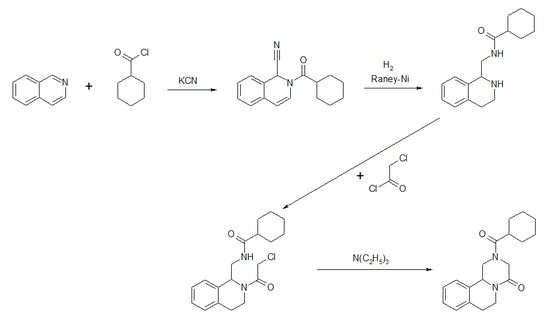
Eine vierstufige Synthese geht vom Isochinolin aus[8][9][6], wobei im ersten Schritt in Gegenwart von Kaliumcyanid mittels Cyclohexancarbonsäurechlorid eine N-Acylierung entsprechend der Reissert-Reaktion realisiert wird. Die resultierende Additionsverbindung wird dann in Gegenwart von Raney-Nickel hydriert, wobei die Cyclohexancarbonsäureamidfunktion umgelagert wird. Im dritten Schritt erfolgt eine zweite N-Acylierung mittels Chloracetylchlorid. Ein Ringschlußreaktion in Gegenwart von Triethylamin ergibt im letzten Schritt die Zielverbindung. Die Synthesesequenz führt zum Racemat.
Die Auftrennung der Enantiomeren aus dem Racemat kann durch eine stufenweise Kristallisation aus Methanol bzw. durch eine kontinuierliche Gegenstromchromatographie über chirale Säulenmaterialien mit Hexan/Propanol-Gemischen erfolgen.[10]
Eigenschaften
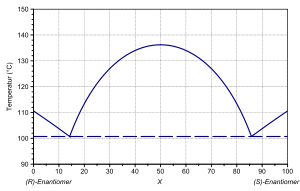
Praziquantel ist chiral und enthält ein Stereozentrum, es gibt also zwei Enantiomere. Die (R)- und die (S)-Form zeigen einen Schmelzpunkt von 110,6 °C. Die Schmelzenthalpie beträgt 18,5 kJ·mol−1, die Schmelzentropie 48,18 kJ·mol−1·K−1.[2][3] Das Racemat liegt als racemische Verbindung vor, welche einen Schmelzpunkt von 136,2 °C zeigt. Für das Racemat wurde eine Schmelzenthalpie von 25,7 kJ·mol−1 und eine Schmelzentropie von 62,89 kJ·mol−1·K−1 bestimmt.[2][3] Im Phasendiagramm zeigen sich zwischen Enantiomer und Racemat eutektische Schmelzen bei 101 °C mit einem Enantiomerengehalt von 14 %. Aus einer glasig erstarrten Schmelze des Racemats kann bei 90–100 °C eine zweite polymorphe Form mit einem Schmelzpunkt zwischen 133–135 °C erhalten werden.[11]
Die Handelspräparate enthalten den Arzneistoff als Racemat. Die Löslichkeiten des Racemats bei 25 °C betragen in Wasser 0,4 g·l−1[12], in Methanol 158 g·l−1[3], in Ethanol 97 g·l−1[12] und in 2-Propanol 54 g·l−1[3]. Die Temperaturabhängigkeit der Löslichkeit in Methanol ist in folgender Tabelle angegeben:[3]
T in °C 5,4 9,2 15,6 19,1 24,3 29,2 34,7 38,3 S in g·l−1 64,2 75,1 101,7 120,5 157,5 207,9 290,5 363,6 Die Kristallstruktur wurde bisher nur vom (R)- bzw. (-)-Enantiomer untersucht. Dieses kristallisiert in einem monoklinen Kristallgitter und liegt, resultierend aus der Kristallisation aus Methanol/Wasser als Hemihydrat vor.[13]
Anwendung
Praziquantel wird peroral (also durch Schlucken) verabreicht. Seine Plasmahalbwertszeit beträgt – je nach Leber- und Nierenfunktion – ein- bis zweieinhalb Stunden. Es muss je nach Art und Lokalisation des Parasiten in verschiedener Dauer und Dosis gegeben werden. Bei manchen Bandwürmern reicht schon die einmalige Behandlung mit niedriger Dosis (10–25 Milligramm pro Kilogramm Körpergewicht), bei Befall innerer Organe oder gar des Zentralnervensystems ist die Behandlung von bis zu zwei Wochen mit Höchstdosen von bis zu 50 Milligramm pro Kilogramm Körpergewicht indiziert. Praziquantel wird auch veterinärmedizinisch eingesetzt, so auch zur Entwurmung von Aquarienfischen, dort ist aber aufgrund der hohen Fischgiftigkeit eine Kochsalzbehandlung vorzuziehen.[14][15]
Nebenwirkungen
Gelegentlich bis häufig treten Leibschmerzen, Myalgien (Muskelschmerz), Übelkeit, Erbrechen, Inappetenz oder Kopfschmerzen als Ausdruck der Wirkungen auf die menschlichen Calciumkanäle auf. Auch Schwäche, Schwindel, Benommenheit, Müdigkeit sowie Temperaturerhöhung und Urtikaria (Nesselsucht) sind häufig. Selten Meningismus und Verwirrtheit.
Zur Nomenklatur der Häufigkeiten siehe Nebenwirkung.
Handelsnamen
Biltricide (D), Cesol (D), Cysticide (D)
- Tiermedizin
Anipracit, Aniprazol KH, Band-ex, Bihelminth, Caniquantel, Cestocur, Docatel, Dolpac, Droncit, Drontal, Equest Pramox, Equimax, Eqvalan duo, Fenprasel, Fenquantel, Furexel Combi, Milbemax, Plerion, Prazifen-Kombi, Prazinex, Praziquasel, Profender, Professional Tremazol, Strantel, Tremazol, Vermis-Ex, VetBancid
Einzelnachweise
- ↑ a b c Datenblatt PRAZIQUANTEL CRS beim EDQM, abgerufen am 26. Juli 2008.
- ↑ a b c d Liu, Y.; Wang, X.; Wang, J.-K.; Ching, C.B.: Structural Characterization and Enantioseparation of the Chiral Compound Praziquantel in J. Pharm. Sci. 93 (2004) 3039–3046. doi:10.1002/jps.20211.
- ↑ a b c d e f g Liu, Y.; Wang, X.; Wang, J.-K.; Ching, C.B.: Investigation of the Phase Diagrams of Chiral Praziquantel in Chirality 18 (2006) 259–264. doi:10.1002/chir.20251.
- ↑ a b Praziquantel bei ChemIDplus.
- ↑ Datenblatt Praziquantel bei Sigma-Aldrich, abgerufen am 29. Mai 2011.
- ↑ a b c A. Klemmann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances, 4. Auflage (2000),Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9.
- ↑ Merck.de: Praziquantel April 2007.
- ↑ Seubert, J: DE 2457971 (7. Dezember 1974).
- ↑ Andrews, P.; Thomas, H.; Pohlke, R.; Seubert, J.: Praziquantel in Med. Res. Rev. 3 (1983) 147–200. doi:10.1002/med.2610030204.
- ↑ Bee-Gim Lim, Chi-Bun Ching, Reginald B.H. Tan, Siu-Choon NG: Recovery of (−)–Praziquantel from Racemic Mixtures by Continuous Chromatography and Crystallisation in Chem. Eng. Sci. 50 (1995) 2289–2298.
- ↑ Kuhnert–Brandstätter, M.; Geiler, M.; Wurian, I.: Beitrag zur mikroskopischen Charakterisierung und Identifizierung von Arzneimitteln unter Einbeziehungder UV–Spektroskopie in Sci. Pharm. 51 (1983) 34–41.
- ↑ a b Seubert, J.; Pohlke, R.; Loebich, F.: Synthesis and properties of praziquantel, a novel broad spectrum anthelmintic with excellent activity against Schistosomes and Cestodes in Cell. Mol. Life Sci. 33 (1977) 1036–1037. doi:10.1007/BF01945954.
- ↑ Meyer, T.; Sekljic, H.; Fuchs, S.; Bothe, H.; Schollmeyer, D.; Miculka, C.: Taste, A New Incentive to Switch to (R)-Praziquantel in Schistosomiasis Treatment in PLOS Neglected Tropical Diseases 3 (2009) e357. doi:10.1371/journal.pntd.0000357
- ↑ Andrew J. Mitchell und Melissa S. Hobbs "The Acute Toxicity of Praziquantel to Grass Carp and Golden Shiners" North American Journal of Aquaculture, Volume 69, Issue 3 (July 2007); pp. 203–206.
- ↑ George A. and Sparrow P.: "Toxic Treatments in Aquaculture - (II) Praziquantel and its Impact on Goldfish in Baitproduction" J. Fish. Toxic. Biochem. (4), pp. 322-335, 2005.
Weblinks

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- ATC-P02
- Arzneistoff
- Anthelminthikum
- Carbonsäureamid
- Piperazin
- Aromat
- Cyclohexan
- Tetrahydropyridin
- Valerolactam
- Merck KGaA
Wikimedia Foundation.