- Prednisolon
-
Strukturformel 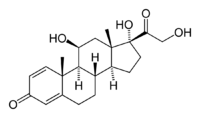
Allgemeines Freiname Prednisolon Andere Namen - 1,4-Pregnadien-11β,17α,21-triol-3,20-dion
- 1,2-Dehydrocortisol
- Prednisolonum (Latein)
Summenformel C21H28O5 CAS-Nummer 50-24-8 PubChem 148534 ATC-Code A07EA01, C05AA04, D07AA03, D07XA02, H02AB06, R01AD02, S01BA04, S01CB02, S02BA03, S03BA02
DrugBank APRD00197 Arzneistoffangaben Wirkstoffklasse Verschreibungspflichtig: Ja Eigenschaften Molare Masse 360,44 g·mol−1 Schmelzpunkt Löslichkeit sehr schlecht in Wasser (223 mg·l−1 bei 25 °C)[2]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [3] 
Achtung
H- und P-Sätze H: 302 EUH: keine EUH-Sätze P: keine P-Sätze [3] EU-Gefahrstoffkennzeichnung [3]
Xn
Gesundheits-
schädlichR- und S-Sätze R: 22 S: keine S-Sätze LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Prednisolon (1,2-Dehydrocortisol; früher auch Metacortandralon oder Deltahydrocortison genannt) ist ein synthetisches Glucocorticoid. Prednisolon ist ein aktiver Metabolit des Prednison.
1957 wurde Prednisolon als „Solu-Decortin H“ von Merck erstmals auf den deutschen Markt gebracht.[4]
Inhaltsverzeichnis
Physikalische Eigenschaften
Prednisolon ist eine feste kristalline Substanz, die in zwei polymorphen Formen und einer Hydratform auftritt.[1] Das kommerzielle Produkt schmilzt bei 239 °C mit einer Schmelzwärme von 33,1 kJ·mol−1.[1] Das zweite Polymorph zeigt einen Schmelzpunkt bei 243 °C mit einer Schmelzwärme von 23,7 kJ·mol−1.[1] Beide Kristallformen stehen somit enantiotrop zueinander, wobei das tiefer schmelzende Polymorph die bei Raumtemperatur thermodynamisch stabilere Form darstellt. Die Hydratform besitzt eine 1,5-Stöchiometrie und kann aus Methanol-Wasser-Gemischen kristallisiert werden.[1] Die Hydratwasserabgabe erfolgt bereits ab 30 °C unter Bildung der höher schmelzenden Kristallform.[1] Alle drei Kristallformen zeigen eine unterschiedliche Löslichkeit.[5]
Wirkung
Prednisolon besitzt eine ausgeprägte immunsuppressive und darüber entzündungshemmende, antiallergische Wirkung. Es ist Wirkstoff der Wahl für systemische antiinflammatorische und immunsuppressive Effekte.[6]
Anwendungsgebiete
Der Wirkstoff wird überall dort eingesetzt, wo es gilt, akute Entzündungsreaktionen zu unterdrücken, so z.B. bei akuten Verschlechterungen der chronisch obstruktiven Lungenerkrankung (COPD) und bei schwerem Asthma Stufe 4, bei rheumatoiden Erkrankungen, entzündlichen Augenerkrankungen, chronisch-entzündlichen Darmerkrankungen, Multipler Sklerose und Autoimmunerkrankungen, Hautkrankheiten, sowie - wenn auch nicht zuverlässig und stichhaltig belegt - bei der Behandlung eines Hörsturzes. Ein weiteres Anwendungsgebiet von Prednisolon ist die vorbeugende Behandlung bei Cluster-Kopfschmerz[7].
Nebenwirkungen
Nebenwirkungen sind aus der immunsuppressiven Wirkung resultierend eine erhöhte Infektanfälligkeit. Ferner sorgt ein kataboler Effekt bei längerer Einnahme für Schädigungen am Knochenbau (Osteopenie bzw. Osteoporose) und ein iatrogenes (durch ärztliche Therapie verursachtes) Cushing-Syndrom. Es kann auch zur Entstehung eines Diabetes mellitus kommen.
Äquivalenzdosen
Die relative entzündungshemmende Äquivalenzdosis anderer Präparate, welche beachtet werden muss, wenn Prednisolon die Einnahme eines anderen Glukokortikoids ersetzen soll, lässt sich aus der folgenden Gleichung ablesen:
5 mg Prednisolon = 5 mg Prednison = 0,7 mg Dexamethason = 4 mg Triamcinolon = 4 mg Methylprednisolon = 20 mg Hydrocortison = 25 mg Cortison.
Handelsnamen
Monopräparate:
Aprednislon (A), Decortin H (D), Dermosolon (D), Dontisolon (D), Hefasolon (D), Hexacorton (CH), Infectocortikrupp (D), Inflanefran (D), Kuehlprednon (A), Linola H (D), Lygal Tinktur (D), Prednisolut (D), Premandol (CH), Solu-Decortin (D), Solu-Dacortin (A), Spiricort (CH), Ultracortenol (D, A, CH), zahlreiche Generika (D, A, CH)
Kombinationspräparate:
Alpicort (D, A, CH), Aquapred (D), Bismolan-H Corti (D), Blephamide (D, CH), Imacort (CH), Imazol comp (D), Inflanegent (D), Klismacort (D), Leioderm P (D), Linoladiol H (D), Locaseptil (CH), Mycinopred (CH), Oxytetracyclin-Prednisolon (D), Scheriproct (A, CH)Einzelnachweise
- ↑ a b c d e f Veiga, M.D.; Cadorniga, R.: Thermal Study of Prednisolone Polymorphs, in: Thermochim. Acta, 1985, 96, S. 111–115, doi:10.1016/0040-6031(85)80012-5.
- ↑ a b Prednisolon bei ChemIDplus.
- ↑ a b c Datenblatt Prednisolone bei Sigma-Aldrich, abgerufen am 22. April 2011.
- ↑ Horst Finger: Der Einfluß von Avil und Solu-Decortin H auf die experimentelle „allergische“ Encephalomyelitis des Meerschweinchens und Kaninchens. Research in Experimental Medicine, Springer Berlin / Heidelberg, 1961, 135 (3), S. 276-280, doi:10.1007/BF02045076.
- ↑ Veiga, M.D.; Cadorniga, Y.R.: Estudio de coeficientes de solubilidad y velocidad de disolucion de diversos polimorfos de la prednisolona, in: Cien. Ind. Farm., 1988, 7, S. 201–205.
- ↑ Pharmacology / H. P. Rang et al. - Edinburgh: Churchill Livingstone, 2003, S. 412.
- ↑ Leitlinie Cluster-Kopfschmerz und trigeminoautonome Kopfschmerzen der Deutschen Gesellschaft für Neurologie. In: AWMF online (Stand 10/2005)
.

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- ATC-A07
- ATC-C05
- ATC-D07
- ATC-H02
- ATC-R01
- ATC-S01
- ATC-S02
- ATC-S03
- Gesundheitsschädlicher Stoff
- Arzneistoff
- Steroidhormon
- Polyol
- Keton
- Dien
- Cyclohexadien
- Cyclohexan
- Cyclopentan
Wikimedia Foundation.
