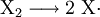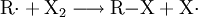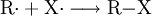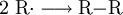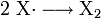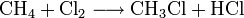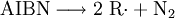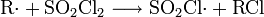- Radikale Substitution
-
Die radikalische Substitution (kurz SR) ist ein Reaktionsmechanismus der organischen Chemie, bei dem Alkane (gesättigte Kohlenwasserstoffe) und Halogene miteinander reagieren. Die Reaktion verläuft als Radikalkettenreaktion nach drei Reaktionsschritten ab:
- Startreaktion
- Kettenfortpflanzung oder Kettenreaktion
- Rekombination oder Abbruchreaktion
Die radikalische Substitution erfolgt nur, wenn Radikale gebildet werden können. Die zur Bildung der Radikale benötigte Energie wird meist durch Licht aufgebracht. Die Reaktion läuft daher umso schneller ab, je heller die Umgebung ist.
Inhaltsverzeichnis
Beschreibung der Reaktionsschritte
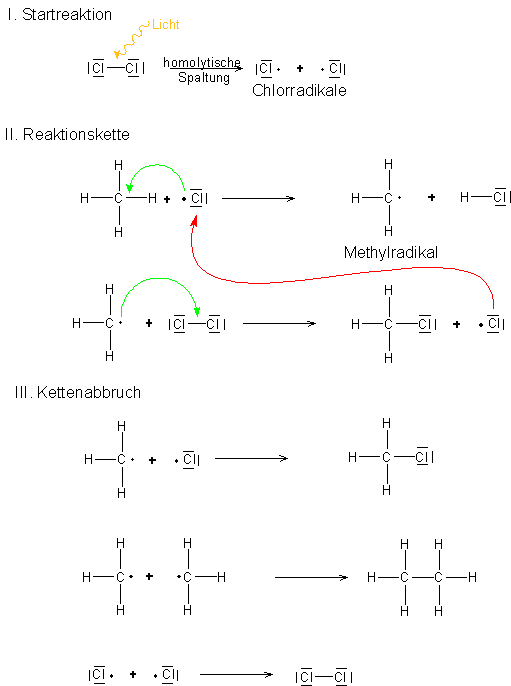
Startreaktion
Bei der Startreaktion wird das Halogenmolekül X2 homolytisch in zwei Halogenradikale gespalten.
Folgereaktion
In der Folgereaktion greift das Halogenradikal die Kohlenwasserstoffkette R–H an und geht eine Elektronenpaarbindung mit einem Wasserstoff-Atom ein. Die restliche Kohlenwasserstoffkette R wird dabei zu einem Alkylradikal.
Das Alkylradikal greift nun ein weiteres Halogenmolekül an und spaltet es homolytisch. Das Radikal bindet mit einem Halogenatom und ein weiteres Halogenradikal entsteht.
Abbruchreaktion
Treffen zwei Radikale aufeinander, gehen sie miteinander eine Elektronenpaarbindung ein. Dabei entstehen keine neuen Radikale.
Beispiel
Hier ist die Reaktion am Beispiel der Reaktion von Methan mit Chlor gezeigt:
Bei der praktischen Durchführung dieser Reaktion kommt es in der Regel immer zur Mehrfachsubstitution, auch wenn mit einem Unterschuss Chlor gearbeitet wird. Das entstandene Produkt Chlormethan (CH3Cl) ist in der radikalischen Substitution ähnlich reaktiv wie Methan. Als Haupt-Produkte entstehen deshalb auch Methylenchlorid (CH2Cl2), Chloroform (CHCl3) und Tetrachlormethan (CCl4). Als Nebenprodukte entstehen Ethan (C2H6) und alle seine Chlor-Derivate.
Aufgrund ihrer geringen Selektivität wird die direkte radikalische Substitution mit Halogenen nur selten eingesetzt. Im Falle des Methans lohnt sie sich trotzdem, da alle Produkte relativ leicht destillativ voneinander getrennt werden können und sich alle gut verkaufen lassen. Man erhält bei dieser Reaktion, trotz ihrer geringen Selektivität, damit kein unbrauchbares Nebenprodukt.
Der Reaktionsmechanismus verläuft folgendermaßen:
Im Labor wird allerdings nicht elementares Chlor zur radikalischen Substitution verwendet. Es wird aus sicherheitstechnischen und praktischen Gründen (Chlor ist beispielsweise stark giftig, korrosiv und schwierig dosierbar) auf Chlorierungsmittel zurück gegriffen. Die gebräuchlichsten Chlorierungsmittel sind Sulfurylchlorid (SO2Cl2) und N-Chlorsuccinimid. Diesen Stoffen muss zusätzlich noch eine kleine Menge Initiator beispielsweise AIBN zugegeben werden, um die höhere Dissoziationsenergie der Cl–SO2Cl Bindung zu überwinden.
Im ersten Schritt der Startreaktion zerfällt unter Wärmezufuhr das AIBN in zwei Radikale (R·) und Stickstoff:
Nun greift das Radikal das Sulfurylchlorid an:
Es schließen sich analog zur radikalischen Substitution mit elementaren Chlor die Kettenfortpflanzungsschritte und die Kettenabbruchreaktionen an.
Nachweis von Halogenkohlenwasserstoffen
Halogenkohlenwasserstoffe weisen in Verbindung mit Kupfer eine grüne Flammenfärbung auf, die von entstehenden Kupferhalogeniden herrührt. Dieses Nachweisverfahren ist unter dem Namen Beilsteinprobe bekannt.
Siehe auch
Weblinks
Cycloaddition | Elektrophile Addition | Elektrophile Substitution | Eliminierung | Nukleophile Addition | Nukleophile Substitution | Oxidation | Radikalische Addition | Radikalische Substitution | Reduktion | Umlagerung
Wikimedia Foundation.