- Chlormethan
-
Strukturformel 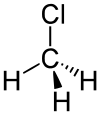
Allgemeines Name Chlormethan Andere Namen - Methylchlorid
- Monochlormethan
- R 40
Summenformel CH3Cl CAS-Nummer 74-87-3 PubChem 6327 Kurzbeschreibung farbloses, etherisch riechendes Gas[1]
Eigenschaften Molare Masse 50,49 g·mol−1 Aggregatzustand gasförmig
Dichte 2,31 g·l−1 (0 °C)[1]
Schmelzpunkt Siedepunkt −23,76 °C[1]
Dampfdruck Löslichkeit schlecht in Wasser (5 g·l−1)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 


Gefahr
H- und P-Sätze H: 220-351-373 EUH: keine EUH-Sätze P: 210-281-410+403 [3] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Gesundheits-
schädlichHoch-
entzündlich(Xn) (F+) R- und S-Sätze R: 12-40-48/20 S: (2)-9-16-33 MAK 50 ml·m−3[1]
GWP 13 (bezogen auf 100 Jahre) [4]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Methylchlorid oder Chlormethan ist ein farbloses, schwach süßlich riechendes, gesundheitsschädliches und leicht brennbares Gas.
Inhaltsverzeichnis
Vorkommen
Methylchlorid ist die häufigste chlorhaltige Verbindung in der Atmosphäre. Neben den industriellen Quellen tragen natürliche Emissionen aus immergrünen Bäumen, aber auch aus anderen Pflanzen wie Kartoffeln, zu erheblichen Mengen bei.[5]
Gewinnung
Chlormethan kann durch Erhitzen von Chlor und Methan auf 400–500 °C erzeugt werden. Bei dieser Temperatur findet eine schrittweise radikalische Substitution bis hin zu Tetrachlormethan statt:




- Methan reagiert mit Chlor unter Bildung von Chlorwasserstoff zunächst zu Chlormethan, und weiter zu Dichlormethan, Trichlormethan und schließlich Tetrachlormethan.
Das Ergebnis des Prozesses ist eine Mischung der vier Chlormethane, welche durch Destillation getrennt werden können.
Technisch wird Methanol hydrochloriert.
Verwendung
Chlormethan wird als Methylierungsmittel in der organischen Chemie, zur Veretherung von Alkoholen und Phenolen sowie bei der Silikonherstellung eingesetzt. Seine hohe Verdampfungswärme ermöglicht auch einen Einsatz als Kältemittel. Früher wurde es zur Narkose, aber auch als lokales Kälteanästhetikum verwendet.
Sicherheitshinweise
Das betäubende Gas löst Störungen des Zentralnervensystems aus und schädigt Leber, Niere und Herz. Methylchlorid gilt als Stoff mit begründetem Verdacht auf krebserzeugendes Potenzial und der Fruchtschädigung.
Die Explosionsgrenze liegt zwischen 7,1 Vol.-% und 18,5 Vol.-% in der Luft.
Einzelnachweise
- ↑ a b c d e f g Eintrag zu Chlormethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8.12.2007 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 74-87-3 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Chloromethane bei Sigma-Aldrich, abgerufen am 22. März 2011.
- ↑ P. Forster, P., V. Ramaswamy et al.: Changes in Atmospheric Constituents and in Radiative Forcing. In: Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge und New York 2007, S. 213, (PDF).
- ↑ Gordon W. Gribble: Umweltgifte von Gabentisch der Natur. In: Spektrum der Wissenschaft Juni 2005, S. 38ff; PDF
Weblinks
- EG Sicherheitsdatenblatt
- Universität Würzburg Betriebsanweisung Chlormethan
- Gordon W. Gribble: Umweltgifte von Gabentisch der Natur. In: Spektrum der Wissenschaft Juni 2005, S. 38ff; PDF
Kategorien:- Stoff mit Verdacht auf krebserzeugende Wirkung
- Feuergefährlicher Stoff
- Gesundheitsschädlicher Stoff
- Chloralkan
- Kühlmittel
Wikimedia Foundation.
