- Radioisotop
-
Als Radionuklide oder radioaktive Nuklide bezeichnet man instabile Atomsorten, deren Kerne radioaktiv zerfallen.
Inhaltsverzeichnis
Definitionen und Sprachgebrauch
Eine Atomkernsorte (ein Nuklid) ist durch die Kernladungszahl (Ordnungszahl) Z und die Massenzahl (Nukleonenzahl) A gekennzeichnet:
Ein Nuklid X wird daher wie folgt gekennzeichnet:
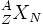 , z. B.:
, z. B.:
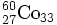 ,
,
- vereinfacht: 60Co oder Co-60. Hier sind Kernladungszahl und Neutronenzahl fortgelassen; die Kernladungszahl ist ja durch das Symbol und die Neutronenzahl als Differenz Massenzahl minus Kernladungszahl festgelegt.
Atomarten mit der gleichen Kernladungszahl (nicht aber Massenzahl), die damit demselben Element zugehören, heißen Isotope. So haben 31P, 32P, 33P, die Isotope des Phosphors, unterschiedliche Kernmassen (Massenzahlen), verhalten sich jedoch chemisch gleich.
Es hat sich eingebürgert, radioaktive Atomarten allgemein als Radionuklide zu bezeichnen; der Begriff Radioisotop sollte nur noch dann verwendet werden, wenn neben der Radioaktivität auch die Zugehörigkeit zu einem bestimmten Element von Bedeutung ist. Allerdings ist die Bezeichnung Isotop anstelle von Nuklid oder speziell Radionuklid als Bestandteil vieler Fachbegriffe wie „Isotopenlabor“, „Isotopenmethode“ oder „Radioisotopengenerator“ nach wie vor anzutreffen.
Ein Radionuklid ist, außer durch Kernladungs-, Neutronen- und Massenzahl, durch seine Zerfallseigenschaften wie Halbwertszeit, Zerfallsart und Zerfallsenergie gekennzeichnet.
Zerfallsereignisse
Beim spontanen Zerfall eines Radionuklids entsteht Alpha-, Beta- und/oder Gammastrahlung. Die Geschwindigkeit dieses Zerfalls steht als Halbwertszeit (T½) fest: nach einer Halbwertszeit ist die Hälfte aller anfangs vorhandenen Atome noch nicht zerfallen, nach zwei Halbwertszeiten nur noch ein Viertel usw.
Man unterscheidet natürliche und künstliche Radionuklide.
Grundsätzlich sind alle Radionuklide auch künstlich erzeugbar. Deshalb ist das Vorkommen mancher natürlicher Radionuklide seit Beginn des kerntechnischen Zeitalters erhöht. Beispiele sind Kohlenstoff-14 (14C) und das Wasserstoff-Isotop Tritium (3H).Einteilungen
Natürliche Radionuklide
Natürliche Radionuklide kommen in der Biosphäre oder in der Erde vor. Sie stammen zum Teil aus dem Reservoir der bei der stellaren Nukleosynthese gebildeten Nuklide, insbesondere die schweren mineralischen Radionuklide wie Uran-235. Diese sogenannten primordialen Radionuklide müssen entsprechend lange Halbwertszeiten haben. Da sich der Anteil der bei der Nukleosynthese gebildeten Nuklide modellieren lässt, und die Radionuklide unter diesen gemäß ihren Halbwertszeiten zerfallen, lässt sich aus ihren heute gemessenen Anteilen auf das Alter der die Erde bildenden Materie schließen.
Ein anderer Teil der natürlichen Radionuklide wird kontinuierlich durch die Wechselwirkung hochenergetischer kosmischer Strahlung (Höhenstrahlung) mit der Atmosphäre gebildet. Diese Radionuklide nennt man kosmogen. Das radioaktive Kohlenstoffisotop 14C (Halbwertszeit ca. 5730 Jahre) ist der bekannteste Vertreter dieser Gattung. Siehe Radiokarbonmethode.
Der Rest der natürlichen Radionuklide wird von den wiederum radioaktiven Zerfallsprodukten der ersten Gattung gebildet. Man nennt diese Radionuklide radiogen.
Künstliche Radionuklide
Unter künstlichen Radionukliden versteht man solche, die durch Kernreaktionen (Neutronenbestrahlung), z.B. im Kernreaktor entstehen. Viele künstliche Radionuklide kommen aufgrund ihrer geringen Halbwertszeiten in der Natur nicht in merklichen Mengen vor.
Einteilung der Radionuklide Primordial Kosmogen Radiogen Künstlich - Kohlenstoff 14
- Tritium (Isotop des Wasserstoffes)
- Beryllium 7, 10
- Aluminium 26
- Tritium (auch natürlich vorkommendes Isotop des Wasserstoffes)
- Technetium, alle Isotope
- Plutonium 239 (alpha-Strahler, spaltbar, f. Kernwaffen und Kernspaltungs-Reaktoren geeignet)
- Plutonium 238 (alpha-Strahler, Einsatz in Isotopenbatterien)
- Strontium 90 (Spaltprodukt aus Kernreaktoren)
- Caesium 137 (Spaltprodukt aus Kernreaktoren)
- Promethium, alle Isotope (Spaltprodukte aus Kernreaktoren)
Anwendung
Medizinisch angewandte Radionuklide und Halbwertszeiten Nuklid Halbwertszeit Sauerstoff-15 2 min Kohlenstoff-11 20 min Fluor-18 110 min Technetium-99m 6 h Iod-123 13 h Iod-124 4 d Jod-131 8 d Phosphor-32 14,26 d Cobalt-60 5,27 a
Radionuklide werden in vielen Bereichen der Technik und Naturwissenschaft sowie in der Medizin verwendet. Beim Umgang ist darauf zu achten, dass alle notwendigen Maßnahmen zum Strahlenschutz beachtet und eingehalten werden (vgl. Strahlenschutzverordnung).In der Chemie (genauer Kernchemie) werden Radionuklide beispielsweise als Radioindikatoren eingesetzt. Dabei werden Verbindungen mit Radionukliden markiert, das heißt, es werden Radionuklide in die Verbindung eingebaut (Leitisotope), um zeitliche oder örtliche Veränderungen (beispielsweise Mengenbestimmungen) durchzuführen. Ein Vorteil dieser Methode ist, dass die radioaktiv markierten Verbindungen die gleichen chemischen Reaktionen wie ihre nicht radioaktiven Äquivalente erfahren, aber deutlich besser zu unterscheiden und aufzufinden sind (auch bei niedrigen Konzentrationen).
Analog dazu nutzt die Biologie und Medizin ähnliche Verfahren, um Stoffwechselprozesse im lebenden Organismus sichtbar zu machen und zu untersuchen (Autoradiographie, Radiochromatographie). In der Strahlentherapie kommen umschlossene Radionuklide zur Anwendung, beispielsweise 60Co („Cobaltkanone“); vgl. Nuklearmedizin. Die nebenstehende Tabelle zeigt exemplarisch eine Auswahl einiger Radionuklide und ihre Halbwertszeiten, die vor allem in der Strahlentherapie von Krebs angewendet werden.
In der Technik werden Radionuklide beispielsweise als Energiequelle eingesetzt (vgl. Kernkraftwerk, Radionuklidbatterie).
Gefahrenklassen
Die deutsche Strahlenschutzverordnung teilt Radionuklide je nach Gefährdungspotential in vier Klassen ein.
Siehe auch
Wikimedia Foundation.
