- Rutosid
-
Strukturformel 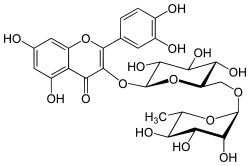
Allgemeines Name Rutin Andere Namen - Rutosid
- Sophorin
- Quercetin-3-O-rutinosid
- Quercetin-3-O-glucorhamnosid
- 3,3′,4′,5,7-Pentahydroxyflavon- 3-O-rutinosid
- C.I. 75730
- C.I. Natural Yellow 10
- Pseudovitamin P
Summenformel C27H30O16 CAS-Nummer 153-18-4 PubChem 5280805 ATC-Code C05CA01
Kurzbeschreibung blaßgelbe bis grünliche Nadeln (Trihydrat) [1] Eigenschaften Molare Masse 610,52 g·mol−1 Aggregatzustand fest
Schmelzpunkt 214–215 °C (Zersetzung) [1]
Löslichkeit unlöslich in Chloroform, Ether und Petrolether; wenig löslich in siedendem Wasser und Ethanol; löslich in Alkalilaugen, Pyridin, Formamid [1]
Sicherheitshinweise Gefahrstoffkennzeichnung [2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: 24/25 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln LD50 WGK 1[2] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Rutin ist ein Flavonoid und ein Glycosid des Quercetin mit dem Dissacharid Rutinose, das sich aus Rhamnose und Glucose zusammensetzt. Rutin wird von vielen Pflanzen als Farbstoff zum Schutz gegen UV-Strahlung gebildet. Antioxidative Wirkungen auf den Menschen sind, wie bei vielen Flavonoiden, nachgewiesen; Ansatzpunkte des Rutin sind insbesondere die Blutgefäße und der Darm.
Inhaltsverzeichnis
Chemische Eigenschaften
Rutin ist ein blassgelbes bis gelbes Pulver, das sich schwer in Wasser (< 5g/l) und gut in heißem Alkohol, allgemein besser in polaren als unpolaren Lösungsmitteln löst. Rutin ist an der Luft stabil und wirkt antioxidativ; es ist in der Lage, gelöstes Vitamin C, z. B. in Fruchtsäften zu stabilisieren. Rutin schmilzt bei einer Temperatur um 200 °C. Durch Abspaltung des Zuckerrests entsteht Quercetin. Rutin bildet mit Metallionen Komplexverbindungen, insbesondere mit Eisen, Kupfer und Aluminium; es sollte daher nicht in solchen Behältern aufbewahrt werden. Allgemein geht Rutin ähnliche Reaktionen ein wie die anderen Flavonoide auch.
Biosynthese und Vorkommen
Rutin wird von vielen Pflanzen in großen Mengen zum Schutz vor UV-Strahlung hergestellt; zusätzlich profitiert die Pflanze von den schwach antimikrobiellen Eigenschaften des Stoffes. Es ist daher nur in den oberirdischen Teilen der Pflanze anzutreffen. Als Flavonoid entsteht es aus dem Phenylpropanoidstoffwechsel und dem Polyketidstoffwechsel. Konkret wird das im Flavonoidstoffwechsel gebildete Naringenin (Flavonol) zu Flavononol hydriert, dieses zu Dihydroquercetin hydroxyliert und dann zu Quercetin dehydriert, welches schließlich glykosyliert wird.
Die Pflanzen mit dem höchsten Rutingehalt (in der Trockenmasse) sind:[4]
Wildes Stiefmütterchen (Viola tricolor, 25%, Blüte), Japanischer Schnurbaum (Sophora japonica, 15–20% Blüte bzw. Blütenknospen, 4% Blätter), Echter Buchweizen (Fagopyrum esculentum, 2–8% Blätter, 4–12% Blüte), Weiße Maulbeere (Morus alba, 6%, Blätter), Kanadischer Holunder (Sambucus canadensis, 3,5%, Blätter), Petersilie (Petroselinum crispum, 3% Blätter), Wasserpfeffer (Persicaria hydropiper, 3% Blätter).
Selbst in Buchweizenmehl waren bei einer Analyse immerhin noch 0,27 Prozent Rutin enthalten.[5]
Gewinnung
Reines Rutin wird momentan hauptsächlich aus China und Brasilien exportiert. In China wurde Rutin trotz der großen Anbaufläche für Buchweizen bis vor kurzem noch aus Knospen des japanischen Schnurbaums (Sophora japonica) extrahiert und hauptsächlich zu Troxerutin weiterverarbeitet. In Brasilien wird eine nur dort beheimatete Urwaldpflanze verwendet.
Bei der traditionellen Herstellung wird Pflanzenmaterial mit 70 bis 85 prozentigem Isopropanol extrahiert und die Lösung anschließend von Fettbestandteilen befreit. Nach Einengung kristallisiert das Produkt.[6]
Metabolismus
Bei oraler Gabe wird Rutin als solches vom Körper nicht im Blutkreislauf aufgenommen. Vielmehr wird Rutin teilweise durch die Darmflora abgebaut, und diese Abbauprodukte sind es, die außerhalb des Darms wirken. Die maximale Verfügbarkeit wird nach sechs bis neun Stunden nach Einnahme erreicht.
Rutin wird zunächst im Dünndarm in der Mucosa festgehalten und durch die dortige Darmflora in Quercetin-3-glucosid umgewandelt, das teilweise ins Blut übergeht und in den Microsomen der Mucosa, aber auch in der Leber zu Quercetin-3-glucuronid umgebaut wird. Der restliche Teil des Rutins wirkt lokal im Darm und wird ins Ileum transportiert, wo es schließlich von einer bestimmten Art der dortigen Darmflora (Eubacterium ramulus) zu Derivaten der Phenylessigsäure abgebaut und im Urin ausgeschieden wird. Physiologisch bedeutsam ist dabei nur 3,4-Dihydroxyphenylessigsäure (3,4-DHPAA), der krebshemmende Eigenschaften zugeschrieben werden.[7][8][9][10][11][12]
Wirkung
Es gibt eine klinische Studie mit 69 Patienten, die die Wirksamkeit von Rutin bei Schwangerschaftsödemen zu belegen scheint. Mehrere Fälle einer Heilung von Purpura, einer Gefäßkrankheit, mittels oraler Gabe von Rutin und Vitamin C sind bekannt. Im Tierversuch wirkt es entzündungshemmend bei chemisch erzeugter Colitis, und zwar noch in Konzentrationen von 0,01 Prozent im Futter.[13][14][15][16]
Im Jahr 2002 waren jedoch auch fünf Fälle bekannt, die nach Einnahme von Rutin eine Darmvenen-Entzündung (Phlebitis) entwickelten, eine sonst seltene Krankheit.[17]
Rutosid (Rutin) und Troxerutin sind als Wirkstoff in Antihämorrhagika und Venentherapeutika zugelassen.
Anwendung
Rutin wird, meist in Form der sauren Natriumsalze, pharmakologisch ähnlich wie Hesperidin gegen kapillare Blutungen und alle mit gesteigerter Kapillarbrüchigkeit und Membrandurchlässigkeit einhergehenden Zustände (aus diesen Gründen wurde Rutin früher oft als sog. Antipermeabilitätsfaktor oder als Vitamin P bezeichnet) eingesetzt – allerdings wurde in den USA 1970 die Zulassung für Rutin und andere Bioflavonoide wegen Fehlens eines Wirkungsnachweis von der FDA zurückgezogen. Zur Behandlung von Venenerkrankungen und Durchblutungsstörungen werden oft synthetische Rutin-Derivate wie Troxerutin und Monoxerutin eingesetzt.[1]
Einzelnachweise
- ↑ a b c d Thieme Chemistry (Hrsg.): Römpp Online. Version 3.1. Georg Thieme Verlag, Stuttgart 2007.
- ↑ a b Datenblatt bei Acros
- ↑ Rutin bei ChemIDplus
- ↑ Dr. Duke's Phytochemical and Ethnobotanical Databases
- ↑ I. Kreft et al.: Rutin content in buckwheat (Fagopyrum esculentum Moench) food materials and products. Food Chem. 98/3/2006. S. 508–12. doi:10.1016/j.foodchem.2005.05.081
- ↑ Y.P.S. Bajaj (Hrsg.): Medicinal and Aromatic Plants V. Vol. 24 in der Reihe Biotechnology in Agriculture and Forestry. Springer 1993. S. 208. ISBN 978-3-540-56008-1
- ↑ C. Manach et al.: Polyphenols: food sources and bioavailability. Review. Am. J. Clin. Nutr. 79/5/2004. S. 727–747. Online Version
- ↑ H. Schneider, Anaerobic transformation of quercetin-3-glucoside by bacteria from the human intestinal tract. Arch. Microbiol. 171/2/1999. S. 81–91 doi:10.1007/s002030050682
- ↑ C. Morand et al.: Respective bioavailability of quercetin aglycone and its glycosides in a rat model. Biofactors. 12/1–4/2000. S. 169–74. PMID 11216481
- ↑ M.R. Olthof et al.: Chlorogenic acid, quercetin-3-rutinoside and black tea phenols are extensively metabolized in humans. J Nutr. 133/6/2003. S. 1806–14. PMID 12771321
- ↑ I. B. Jaganath et al.: The relative contribution of the small and large intestine to the absorption and metabolism of rutin in man. Free Radic Res. 40/10/2006. S. 1035–46. PMID 17015248
- ↑ K. Gao et al.: Of the major phenolic acids formed during human microbial fermentation of tea, citrus, and soy flavonoid supplements, only 3,4-dihydroxyphenylacetic acid has antiproliferative activity. J Nutr. 136/1/2006. S. 52–7. PMID 16365058
- ↑ A.A. Bamigboye und G.J. Hofmeier: Interventions for leg edema and varicosities in pregnancy. What evidence? Eur J Obstet Gynecol Reprod Biol. 129/1/2006. S. 3–8. PMID 16678328
- ↑ U. Reinhold et al.: Treatment of progressive pigmented purpura with oral bioflavonoids and ascorbic acid: an open pilot study in 3 patients. J Am Acad Dermatol. 41/2/1999. S. 207–8. PMID 10426890
- ↑ F. Laufer: The treatment of progressive pigmented purpura with ascorbic acid and a bioflavonoid rutoside. J Drugs Dermatol. 5/3/2006. S. 290–3. PMID 16573267
- ↑ K.H. Kwon et al.: Dietary rutin, but not its aglycone quercetin, ameliorates dextran sulfate sodium-induced experimental colitis in mice: attenuation of pro-inflammatory gene expression. Biochem Pharmacol. 69/3/2005. S. 395–406. PMID 15652231. doi:10.1016/j.bcp.2004.10.015
- ↑ A. Kettaneh et al.: Pseudotumoral enterocolic phlebitis of the cecum and rutoside. A case report (Original in Französisch). Rev Med Interne. 23/5/2002. S. 465–8. PMID 12064219
Literatur
- P. Schopfer, A. Brennicke: Pflanzenphysiologie. 6. Aufl., Elsevier 2006
Bitte beachte den Hinweis zu Gesundheitsthemen!
Wikimedia Foundation.
