- Azodicarbonsäurediethylester
-
Strukturformel 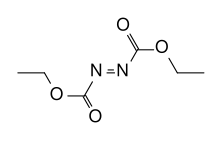
Allgemeines Name Azodicarbonsäurediethylester Andere Namen - Diazendicarbonsäure-diethylester
- Diethylazodiformiat
- Diethylazodicarboxylat
- DAD
- DEAD
- Ethyl(NE)-N-ethoxycarbonyliminocarbamat bzw. Ethyl(NZ)-N-ethoxycarbonyliminocarbamat (IUPAC)
Summenformel C6H10N2O4 CAS-Nummer 1972-28-7 PubChem 5462977 Kurzbeschreibung orangefarbene Flüssigkeit[1]
Eigenschaften Molare Masse 174,15 g·mol−1 Aggregatzustand flüssig
Dichte 1,11 g·cm−3[2]
Siedepunkt Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 
Achtung
H- und P-Sätze H: 302-312-315-319-335 EUH: keine EUH-Sätze P: 261-302+352-305+351+338-321-405-501 [2] EU-Gefahrstoffkennzeichnung [2] 
Gesundheits-
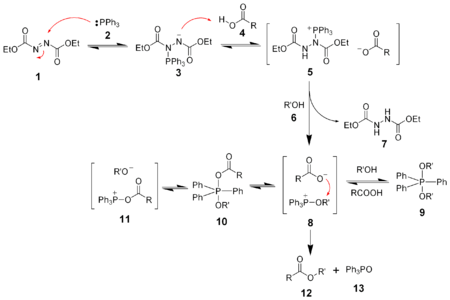
schädlich(Xn) R- und S-Sätze R: 5-21/22-36/37/38 S: 23-26-36/37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Azodicarbonsäurediethylester, meist mit DEAD (Diethylazodicarboxylat) abgekürzt, ist ein wichtiges Reagenz für die Mitsunobu-Reaktion, kann aber vielfältig eingesetzt werden.
Inhaltsverzeichnis
Herstellung
Die Herstellung erfolgt über Derivate des Hydrazins, die durch geeignete Mittel dehydriert werden. Eine Möglichkeit ist die Oxidation mittels rauchender Salpetersäure[3] Die Reaktion gelingt auch unter Verwendung von Chlor als Oxidationsmittel.[4]
Chemische Eigenschaften, Sicherheit
DEAD ist toxisch, stoß- und lichtempfindlich und thermisch instabil. Die Verbindung ist explosionsgefährlich im Sinne des Sprengstoffgesetzes und ist dort der Stoffgruppe A zugeordnet.[5] Kommerziell ist es deshalb meist in gelöster Form, beispielsweise in Toluol, erhältlich. Als Reinstoff darf DEAD in den USA nicht versandt werden. Bedingt durch diese Sicherheitsrisiken ging die Verwendung von DEAD zurück, es wird meist durch das stabilere Diisopropylazodicarboxylat (DIAD) ersetzt.
Beim Destillieren kann DEAD explodieren. Geeignete Sicherheitsvorkehrungen sind zu treffen. Direkte Lichtquellen sollen abgeschirmt werden.[4]
Verwendung
Mitsunobu-Reaktion
Das klassische Anwendungsgebiet von DEAD ist die Mitsunobu-Reaktion, die der Synthese von Estern, Ethern, Aminen und Thioethern aus Alkoholen dient.
Enophil
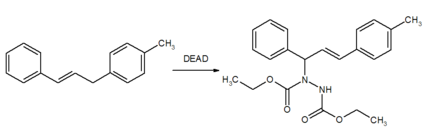
Ein weitere Anwendungsbereich von DEAD ist die Verwendung als Enophil beispielsweise in En-Reaktionen.[6]
Dienophil
Auch die Verwendung als Dienophil ist in der Literatur beschrieben. So gelang beispielsweise die Synthese von Bicyclo[2.1.0]pentan ausgehend von Cyclopentadien und DEAD.[7]
Michael-Akzeptor
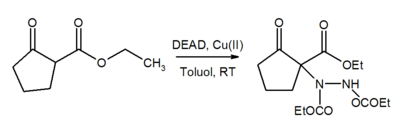
Die Azogruppe in DEAD ist auch ein Michael-Akzeptor. In Gegenwart von Kupferkatalysatoren addiert DEAD an β-Ketoester zu den entsprechenden Hydrazindrivaten.[8]
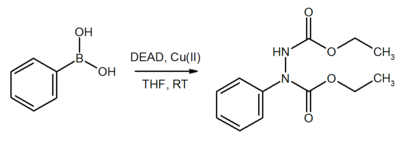
Auf ähnliche Weise katalysiert Cu(II) auch die Substitution von Boronsäureestern in fast quantitativer Ausbeute.[9]
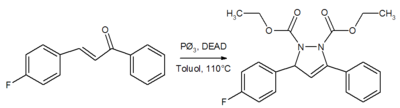
Synthese von Pyrrazolin-Derivaten
DEAD kann auch zur Synthese von Heterocyclen eingesetzt werden. So können Pyrrazolinderivate durch Kondensation an α,β-ungesättigte Ketone erhalten werden.[10]:
Literatur
- Clayden, Greeves, Warren & Wothers : Organic Chemistry. Oxford University Press, August 2004, ISBN 0-19-850346-6
- O. Mitsunobu, M. Wada, T. Sano, J. Am. Chem. Soc. 1972, 94, 679.
- R. F. C. Brown et al., Tetrahedron '1994, 50, 5469. (Methodenentwicklung)
- O. Mitsunobu, Synthesis 1981, 1-28. (Übersicht)
Einzelnachweise
- ↑ a b Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d Datenblatt Azodicarbonsäurediethylester bei AlfaAesar, abgerufen am 17. März 2010 (JavaScript erforderlich)..
- ↑ Organic Syntheses 1948, 28, 58.
- ↑ a b Organic Syntheses Coll. Vol. 4, 411.
- ↑ Bekanntmachungen der gemäß § 2 SprengG von der Bundesanstalt für Materialforschung und -prüfung (BAM) seit 1987 neu getroffenen Feststellungen - Feststellungsbescheid 402 vom 16. Februar 2001
- ↑ Lehmann, Neumann: En-Reaktionm Uni Hannover
- ↑ P. G. Gassman und K. T. Mansfield, Organic Syntheses Coll. Vol. 5 1973, 96.
- ↑ Moreno-Mañas, M. et al. J. Org. Chem. 2004, 69, 6834
- ↑ N. Chatani: J. Org. Chem. 2005, 70, 8631.
- ↑ N. Vijay, C. M. Smith, T. B. Akkattu, S. Eringathodi: Angew. Chem. Int. Ed. 2007, 46, 2070–2073
Wikimedia Foundation.