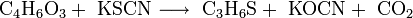- Trimethylencarbonat
-
Strukturformel 
Allgemeines Name 1,3-Dioxan-2-on Andere Namen Trimethylencarbonat
Summenformel C4H6O3 CAS-Nummer 2453-03-4 Kurzbeschreibung farbloser Feststoff[1] Eigenschaften Molare Masse 102,09 g·mol−1 Aggregatzustand fest
Dichte 1,23 g/cm3 (50 °C)[2]
Schmelzpunkt Siedepunkt 83–85 °C (13 Pa)[1]
Sicherheitshinweise Gefahrstoffkennzeichnung [3] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22-36 S: 26 WGK 1 [3] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. 1,3-Dioxan-2-on ist eine chemische Verbindung aus der Gruppe der gesättigten sauerstoffhaltigen Heterocyclen. Sie besteht aus einem sechsgliedrigen Ring, deren 1- und 3-Position durch Sauerstoffatome gebildet werden. In 2-Position befindet sich eine Ketogruppe. Die Verbindung kann auch als cyclisches Carbonat aufgefasst werden.
Inhaltsverzeichnis
Darstellung
Die Darstellung von 1,3-Dioxan-2-on gelingt über die Cyclisierung organischer Carbonate wie Di-tert-butyldicarbonat in Gegenwart der Base DMAP[4] oder Kohlensäurediethylester in Gegenwart von Natriummethanolat bei erhöhter Temperatur[5] mit 1,3-Propandiol.
Es kann auch in sehr guter Ausbeute aus Oxetan unter hohem Kohlenstoffdioxiddruck am Antimonkatalysator erhalten werden.[6]
Eigenschaften
1,3-Dioxan-2-on ist bei Raumtemperatur ein farbloser Feststoff, der bei 47 °C schmilzt. Der Brechungsindex der Flüssigkeit beträgt bei einer Temperatur von 50 °C und einer Wellenlänge von 589 nm 1,4409.[2]
Verwendung
1,6-Dioxan-2-on ist ein Ausgangsstoff zur Herstellung von Polytrimethylencarbonat. Dieses kann durch Ringöffnung mittels einer Lewis-Säure erhalten werden. Es werden nur katalytische Mengen der Lewis-Säure benötigt. Hierzu können beispielsweise Komplexe des Scandiums benutzt werden.[7][8] Auch Copolymere mit Ethylenglycol können auf diese Weise mit Zinkkatalysatoren erhalten werden.[9]
Durch die Reaktion zwischen 1,3-Dioxan-2-on mit Kaliumthiocyanat bei 140 °C kann Thietan hergestellt werden. Als Nebenprodukte entstehen Kaliumcyanat und Kohlenstoffdioxid.[10]
Quellen
- ↑ a b c K. Sommer: Zur Darstellung cyclischer Arsenite und Thioarsenite, in: Z. Anorg. Allg. Chem. 1969, 370, 227–234.
- ↑ a b J. W. Hill, W. H. Carothers: Studies of Polymerization and Ring Formation. XX. Many-Membered Cyclic Esters, in: J. Am. Chem. Soc. 1933, 55, 5031–5039.
- ↑ a b 1,3-Dioxan-2-on bei Sigma-Aldrich (nur im verlinkten MSDS sichtbar)
- ↑ Y. Basel, A. Hassner: Di-tert-butyl Dicarbonate and 4-(Dimethylamino)pyridine Revisited. Their Reactions with Amines and Alcohols, in: J. Org. Chem. 2000, 65, 6368–6380.
- ↑ A. Klys, W. Czardybon, J. Warkentin, N. H. Werstiuk: Synthesis and thermolysis of a spiro-fused oxadiazoline – Evidence for sequential formation of carbene and oxirane intermediates, and for oxirane dimerization., in: Can. J. Chem. 2004, 82, 1769–1773.
- ↑ A. Baba, H. Kashiwagi, H. Matsuda: Cycloaddition of oxetane and carbon dioxide catalyzed by tetraphenylstibonium iodide, in: Tetrahedron Lett. 1985, 26, 1323–1324.
- ↑ J. Ling, W. Zhu, Z. Shen: Controlling Ring-Opening Copolymerization of -Caprolactone with Trimethylene Carbonate by Scandium Tris(2,6-di-tert-butyl-4-methylphenolate), in: Macromolecules 2004, 37, 758–763.
- ↑ L. Zhou, Y. Yao, Y. Zhang, M. Xue, J. Chen, Q. Shen: Synthesis and Characterization of Homoleptic Lanthanide Guanidinate Complexes and Their Catalytic Activity for the Ring-Opening Polymerization of Trimethylene Carbonate, in: Eur. J. Inorg. Chem. 2004, 10, 2167–2172.
- ↑ F. Meng, C. Hiemstra, G. H. M. Engbers, J. Feijen: Biodegradable Polymersomes, in: Macromolecules 2003, 36, 3004–3006.
- ↑ S. Searles, E. F. Lutz in: A new synthesis of small ring cyclic sulfides, in: J. Am. Chem. Soc. 1958, 80, 3168.
Wikimedia Foundation.