- Kaliumcyanat
-
Strukturformel 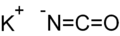
Allgemeines Name Kaliumcyanat Summenformel KCNO CAS-Nummer 590-28-3 PubChem 11378442 Kurzbeschreibung weißer, geruchloser Feststoff[1]
Eigenschaften Molare Masse 81,12 g·mol−1 Aggregatzustand fest
Dichte 2,06 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt Zersetzung bei > 700 °C[1]
Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 
Achtung
H- und P-Sätze H: 302 EUH: keine EUH-Sätze P: 262 [4] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 22 S: (2)-24/25 LD50 567 mg·kg−1 (oral, Ratte)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kaliumcyanat ist das Kaliumsalz der Cyansäure bzw. der Isocyansäure - eine Unterscheidung lässt sich nicht treffen, da das Anion ein mesomeres System darstellt und die Anionen beider Säuren somit identisch sind. Da allerdings die Längen der Bindungen zwischen Kohlenstoff und Stickstoff sowie zwischen Kohlenstoff und Sauerstoff eher Doppelbindungen entsprechen als einer Einfach- und einer Dreifachbindung[5], wäre die Bezeichnung Kaliumisocyanat eher gerechtfertigt; sie ist aber unüblich.
Inhaltsverzeichnis
Herstellung
Kaliumcyanat wird technisch durch Einleiten von Luft in eine Kaliumcyanidschmelze hergestellt.
Die Oxidation von Kaliumcyanid gelingt auch mit anderen Oxidationsmitteln wie Braunstein, Blei(IV)-oxid, Kaliumdichromat[2] oder Kaliumpermanganat. Im Labor kann es durch Zusammenschmelzen von Harnstoff und Kaliumcarbonat hergestellt werden.
Eigenschaften
Kaliumcyanat bildet farblose, nadelförmige Kristalle. Es ist in reinem Zustand geruchlos; technische Produkte können einen schwachen Geruch aufweisen, der zum Teil von Blausäure verursacht wird, die aus der herstellungsbedingt vorhandenen Verunreinigung durch Kaliumcyanid entsteht. Der Schmelzpunkt liegt etwa bei 315 °C. Bei Raumtemperatur besitzt es eine Dichte von ca. 2,056 g/cm3. Es ist sehr gut löslich in Wasser (es lösen sich 750 g Kaliumcyanat pro Liter). Das Salz ist in Alkohol unlöslich. Beim Erhitzen auf Temperaturen über 700 °C zerfällt es in Kaliumcyanid und Sauerstoff. In wässriger Lösung hydrolisiert es langsam zu Ammoniumcarbonat.[2]
Verwendung
Kaliumcyanat wurde Ende der 1940er Jahre in den USA als Herbizid verwendet, da es für viele Pflanzen als Gift wirkt. Es wurde jedoch nie großflächig eingesetzt.[6] In Deutschland, Österreich und der Schweiz ist kein Pflanzenschutzmittel zugelassen, das diesen Wirkstoff enthält.[7] Heute wird es zur Oberflächenhärtung von Metallen[8] und bei der Synthese von organischen Verbindungen wie Harnstoff-Derivaten und Carbamaten[4] (zum Beispiel von Hydantoin oder Semicarbazide) eingesetzt.[2]
Sicherheitshinweise
Kaliumcyanat ist schwach wassergefährdend und gesundheitsschädlich. Beim Erhitzen auf über 700°C entsteht das hochgiftige Kaliumcyanid.
Einzelnachweise
- ↑ a b c d e f Datenblatt Kaliumcyanat bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b c d Karl-Heinz Lautenschläger, Werner Schröter, Andrea Wanninger: Taschenbuch der Chemie. 2005, ISBN 978-3817117604 (Seite 596 in der Google Buchsuche).
- ↑ a b Eintrag zu CAS-Nr. 590-28-3 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ a b Eintrag zu CAS-Nr. 590-28-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. April 2011 (JavaScript erforderlich).
- ↑ Holleman-Wiberg, Lehrbuch der Anorganischen Chemie, 101. Auflage, de Gruyter Verlag 1995
- ↑ Robert L. Zimdahl: A History of Weed Science in the United States. 2010, ISBN 978-0123814951 (Seite 109 in der Google Buchsuche).
- ↑ Nationale Pflanzenschutzmittelverzeichnisse: Schweiz, Österreich, Deutschland; abgerufen am 16. Dezember 2008
- ↑ Wolfgang Weißbach: Werkstoffkunde: Strukturen, Eigenschaften, Prüfung. 2009, ISBN 978-3834807397 (Seite 163 in der Google Buchsuche).
Kategorien:- Gesundheitsschädlicher Stoff
- Kaliumverbindung
- Cyanat
- Herbizid
- Pflanzenschutzmittel (Wirkstoff)
Wikimedia Foundation.



