- Benzapyren
-
Strukturformel 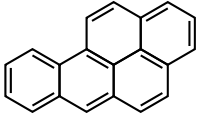
Allgemeines Name Benzo[a]pyren (abgekürzt: B(a)p) Andere Namen - 1,2-Benzpyren
- Benzo[def]chrysen
Summenformel C20H12 CAS-Nummer 50-32-8 Kurzbeschreibung gelbliche[1], vom Geruch her aromatische Substanz Eigenschaften Molare Masse 252,32 g·mol−1 Aggregatzustand fest
Dichte 1,28 g·cm−3 (20 °C) [1]
Schmelzpunkt Siedepunkt 495,5 °C [1]
Löslichkeit praktisch unlöslich in Wasser, löslich in organischen Lösungsmitteln [2]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Giftig Umwelt-
gefährlich(T) (N) R- und S-Sätze R: 43-45-46-50/53-60-61 S: 45-53-60-61 MAK nicht eingestuft, da Verdacht auf krebserzeugende Wirkung[1]
WGK 3[1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Benzo[a]pyren (1,2-Benzpyren) ist ein polyzyklischer aromatischer Kohlenwasserstoff. Die veraltete Bezeichnung für diese chemische Verbindung lautet 3,4-Benzpyren. Nach IUPAC ist der korrekte Name Benzo[def]chrysen.
Inhaltsverzeichnis
Vorkommen und Entstehung
Benzo[a]pyren kommt im Steinkohlenteer vor. Zudem entsteht es bei der unvollständigen Verbrennung von organischen Stoffen und ist infolge dessen weit verbreitet. So findet man es in Auto- und Industrieabgasen. Während des Rauchens von Zigaretten wird es bei ungefähr 300 °C in der Tabakbrennzone gebildet, aber auch beim Rösten von Kaffeebohnen entstehen geringe Mengen (0,3 bis 0,5 µg·kg−1). [4]
In Grillprodukten, die über Holzkohle oder Kiefernzapfen zubereitet wurden, lässt sich Benzo[a]pyren nachweisen. Spuren von Benzo[a]pyren kommen im Boden, in Gemüse und Getreide vor.
Die Stiftung Warentest konnte in einem Test zu Bitterschokolade im November 2007 den krebserregenden Stoff in einer Tafel der Rapunzel Naturkost AG feststellen und bewertete diese mit „mangelhaft“. Der Hersteller nahm dieses Produkt sofort vom Markt.[5]
Gewinnung und Darstellung
Benzo[a]pyren lässt sich aus Kohlenteer und anderen Teeren durch Extraktion gewinnen. Eine Synthese kann durch katalytische Hydrierung von Cycloalkanen in Gegenwart der Übergangsmetalle Platin, Palladium und Nickel bewerkstelligt werden. Eine alternative Hydrierungsmethode ist die bei Hitze, wenn man die Elemente Selen und Schwefel sowie Disulfide als Katalysator einsetzt.
Struktur
Das Benzo[a]pyren-Molekül gehört zu den pentanuklearen, d. h. aus fünf Benzol-Ringen bestehenden polyzyklischen aromatischen Kohlenwasserstoffen. Die Ringe sind über ihre Kanten miteinander verbunden (annelliert). Das Molekül besitzt, wie Benzol aufgrund des delokalisierten π-Elektronensystems, aromatischen Charakter.
Eigenschaften
Benzo[a]pyren ist ein gelber, kristalliner Feststoff, der entweder in Form von Plättchen mit einer Dichte von 1,282 g·cm−3 oder als Nadeln (Dichte 1,351 g·cm−3) vorliegt. Benzo[a]pyren schmilzt bei 179 °C und siedet bei 495 °C. In Wasser und Alkoholen ist es un- bzw. gering löslich. In aromatischen Kohlenwasserstoffen löst es sich hingegen gut, in Benzol z.B. unter violetter Fluoreszenz.
Sicherheitshinweise
Benzo[a]pyren hat einen TRK-Wert von 0,002 mg/m³. Der KOC-Wert beträgt 4.500.000 l/kg (Sediment) und der log KOW-Wert 6,15.
Karzinogen
Benzo[a]pyren ist eine der am längsten bekannten und untersuchten krebserregenden (karzinogenen) Substanzen. Das Risiko, dass Zigarettenrauch Lungenkrebs hervorruft, wird zu einem großen Teil auf Benzo(a)pyren zurückgeführt. Benzopyren selbst ist dabei nicht giftig, wird allerdings im Körper in eine Epoxidform umgewandelt, die sich an die DNA (genauer gesagt an Guanin) binden kann und dann die Struktur der DNA beeinträchtigt, was Zellteilung verhindern oder zu Mutationen führen kann.
Ökologie
Es gilt als Prototyp der polyzyklischen aromatischen Kohlenwasserstoffe. In der Bestimmung der Umweltbelastung durch diese Stoffgruppe wird meist Benzo[a]pyren als Referenz verwendet. Benzopyren wird nach seinem Gefährdungspotential als giftig und umweltgefährlich bezeichnet.
Nachweis
Benzo[a]pyren kann man mit Hilfe von Fluoreszenzspektroskopie nachweisen. Aus Gemischen mit anderen Verbindungen kann es durch Dünnschichtchromatographie oder HPLC isoliert werden.
Quellenangaben
- ↑ a b c d e f Eintrag zu CAS-Nr. 50-32-8 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 15.01.2008 (JavaScript erforderlich)
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, Seite 172.
- ↑ Eintrag zu CAS-Nr. 50-32-8 im European chemical Substances Information System ESIS
- ↑ Fritz W, Zur Bildung cancerogener Kohlenwasserstoffe bei der thermischen Behandlung von Lebensmitteln., in Mitt. Nahrung, 12/1968, S.639.
- ↑ Täglicher Anzeiger Holzminden vom 22. November 2007, Bitterschokolade "Bio Negro" vom Markt genommen
Wikimedia Foundation.
