- Butenin
-
Strukturformel 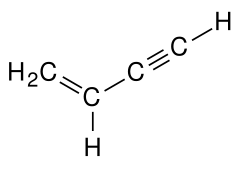
Allgemeines Name Vinylacetylen Andere Namen - Butenin
- Vinylacetylen
- 1-Buten-3-in
- Monovinylacetylen
- But-1-en-3-in (IUPAC)
Summenformel C4H4 CAS-Nummer 689-97-4 PubChem 12720 Eigenschaften Molare Masse 52,07 g·mol−1 Aggregatzustand gasförmig
Dichte 0,71 g·l−1 (0 °C, 1013 hPa)[1]
Schmelzpunkt Siedepunkt 5 °C[1]
Dampfdruck Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Butenin, häufig auch als Vinylacetylen bezeichnet, ist ein farbloses Gas. Es ist eine organisch-chemische Verbindung und ist der kleinstmögliche Vertreter der Enine, einer Gruppe mehrfach ungesättigter Kohlenwasserstoffe, die strukturell sowohl Alken- als auch Alkincharakter haben.
Inhaltsverzeichnis
Herstellung
Im Labor ist es am einfachsten durch zweifache Dehydrohalogenierung (Eliminierung) von 1,3-Dichlor-2-buten zugänglich.[3] Technisch ist Butenin durch die Dimerisation von Ethin (Acetylen) herstellbar. Die Dimerisation wird durch den Einsatz eines Nieuwland-Katalysators (Kupfer(I)-chlorid) in wässriger Phase begünstigt.[4] Butenin wurde in größeren Mengen erstmals von Mitarbeitern der Firma DuPont 1931 produziert.[5]
Eigenschaften
Als stark ungesättigte Verbindung neigt Vinylacetylen zum spontanen Zerfall. Es ist nicht lagerstabil und in reiner Form nicht käuflich erhältlich. Aus Sicherheitsgründen sollte es nur mit inerten Gasen verdünnt gehandhabt werden. Auch wenn es noch keine offizielle Gefahrstoffkennzeichnung trägt, so ist es – wie jeder gasförmige Kohlenwasserstoff – als hochentzündlich zu betrachten. Seine Gemische mit Luft sind in bestimmten Konzentrationsgrenzen explosionsgefährlich.
Weitere physikalische Daten
Die kritische Temperatur liegt bei 183 °C.
Verwendung
Vinylacetylen wurde früher als Zwischenprodukt für die Synthese von Chloropren (2-Chlor-1,3-butadien) verwendet. Das Chloropren wurde durch Addition von Chlorwasserstoff an Butenin hergestellt.[6]
Vinylacetylen lässt sich kontrolliert zu Polyvinylacetylen polymerisieren,[7] das beispielsweise als Ausgangsprodukt für Kohlenstofffasern geeignet ist.[8]
Einzelnachweise
- ↑ a b c d Eintrag zu CAS-Nr. 689-97-4 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Juli 2008 (JavaScript erforderlich).
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ G. F. Hennion u. a.: Monovinylacetylene In: Organic Syntheses 4/1963, S. 683.
- ↑ K. Weissermel, H. J. Arpe Industrielle organische Chemie: Bedeutende vor- und Zwischenprodukte. Wiley-VCH, 2007, S. 132, ISBN 3-527-31540-3.
- ↑ J. A. Nieuwland u. a.: Acetylene Polymers and Their Derivatives. I. The Controlled Polymerization of Acetylene. In: Journal of the American Chemical Society 53/1932, S. 4197ff.
- ↑ W. H. Carothers u. a.: Acetylene Polymers and their Derivatives. II. A New Synthetic Rubber: Chloroprene and its Polymers In: Journal of the American Chemical Society 53/1937, S. 4203–4225.
- ↑ S. G. Grigoryan u. a.: Polymerization of vinylacetylene compounds under the action of palladium salt in conditions of homogeneous catalysis. In: Polymer Science U.S.S.R. 27/1985, S. 1886–1890.
- ↑ A. Mavinkurve u. a.: An initial evaluation of poly(vinylacetylene) as a carbon fiber precursor. In: Carbon 33/1995, S. 757–761.
Literatur
- H. Siegel u. a.: Alkine und Cumulene, XVII. Photoadditionen von Vinylacetylen an andere ungesättigte Kohlenwasserstoffe. In: Chemische Berichte 118/1984, S.597–612.
- H. W. Morgan, J. W. Goldstein: The Microwave Spectrum of Vinylacetylene. In: J. Chem. Phys. 20/1952, S. 1981.
- A. Fahr, A. Nayak: Temperature dependent ultraviolet absorption cross sections of propylene, methylacetylene and vinylacetylene. In: Chemical Physics 203/1996, S. 351–358.
- T. Bally u. a.: The electronic structure of the radical cations of butadiene, vinylacetylene and diacetylene: similarities and In: Chemical Physics Letters 190/1992, S. 453–459.
Weblinks
Wikimedia Foundation.
