- Ethylphenole
-
Ethylphenole Name 2-Ethylphenol 3-Ethylphenol 4-Ethylphenol Andere Namen 2-Ethylhydroxybenzol 3-Ethylhydroxybenzol 4-Ethylhydroxybenzol Strukturformel 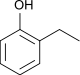
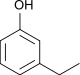
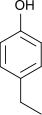
CAS-Nummer 90-00-6 620-17-7 123-07-9 PubChem 6997 12101 31242 Summenformel C8H10O Molare Masse 122,16 g·mol−1 Aggregatzustand flüssig fest Beschreibung gelbbraune Flüssigkeit[1] hellgelbe Flüssigkeit[2] gelber Feststoff[3] Schmelzpunkt −18 °C[1] −4 °C[2] 40–42 °C[3] Siedepunkt 207 °C[4] 217 °C[4] 219 °C[4] Dichte 1,037 g/ml (25 °C)[5][6] 1,001 g/ml (25 °C)[2] 0,98 g/ml (25 °C)[7] Dampfdruck 0,17 hPa (20 °C)[3] Löslichkeit 4,9 g/l (25 °C)[8] pKs-Wert[4] 10,2 9,90 10,01 GHS-
Einstufung
Gefahr

Achtung
Achtung
H- und P-Sätze 302-315-318-335 302-312-315-319-332-335 315-319-335 keine EUH-Sätze keine EUH-Sätze keine EUH-Sätze 261-280-305+351+338 261-280-305+351+338 261-305+351+338 Gefahrstoff-
kennzeichnung
[5][2][3]
Gesundheits-
schädlich(Xn) 
Reizend (Xi) R-Sätze 22-37/38-41 20/21/22-36/37/38 36/37/38 S-Sätze 36/37/39 26-37/39 26-36 LD50 600 mg/kg (Maus, oral)[5] 138 mg/kg (Maus, i.p.)[3] Die Ethylphenole bilden eine Stoffgruppe, die sich sowohl vom Phenol als auch vom Ethylbenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Hydroxygruppe (–OH) und Ethylgruppe (–CH2–CH3) als Substituenten. Durch deren unterschiedliche Anordnung (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C8H10O. In erster Linie kann man sie als ethylsubstituierte Phenole ansehen.
Inhaltsverzeichnis
Darstellung
o- und p-Ethylphenol
Die Synthese von o- und p-Ethylphenol geht vom Ethylbenzol aus, das durch eine Friedel-Crafts-Alkylierung aus Benzol und Bromethan mit Aluminiumchlorid als Katalysator hergestellt werden kann. Nitrierung mit Salpetersäure und Schwefelsäure führt zu einem Gemisch von o-Ethylnitrobenzol und p-Ethylnitrobenzol, das mit Eisen und Salzsäure zu den entsprechenden Ethylanilinen reduziert wird. Die Trennung der beiden Isomere wird nach Acetylierung der Aminogruppen durch Essigsäureanhydrid durchgeführt – das p-Isomer ist schlecht wasserlöslich, wohingegen das o-Isomer in Lösung bleibt. Durch Kochen mit Salzsäure werden die Amide verseift und nach einer Diazotierung mit Natriumnitrit und anschließendem Verkochen des Diazoniumsalzes werden die gewünschten Verbindungen erhalten.[6]
m-Ethylphenol
Ein Syntheseweg von m-Ethylphenol geht vom p-Ethylanilin aus, das mit Essigsäureanhydrid acetyliert wird, um nach anschließender Nitrierung und Verseifung des Amids mit Salzsäure 4-Ethyl-2-nitroanilin zu erhalten. Die Aminogruppe wird diazotiert und mit Schwefelsäure entfernt, das dabei entstehende 3-Ethylnitrobenzol wird mit Eisen und Salzsäure zum m-Ethylanilin reduziert. Erneutes Diazotieren und Verkochen des Diazoniumsalzes liefert das gewünschte m-Ethylphenol.[6]
Eigenschaften
Das 4-Ethylphenol, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt. Es ist im Gegensatz zu den anderen beiden Isomeren ein Feststoff. Die Ethylgruppe hat nur geringen Einfluss auf die Acidität der phenolischen OH-Gruppe, die pKs-Werte weisen nur geringfügige Unterschiede zum Phenol (9,99[4]) auf.
Bedeutung im Wein
Der Hefepilz Brettanomyces bruxellensis ist u. a. verantwortlich für einen Weinfehler, vor allem in Rotweinen. Die geschmacksbildenden Substanzen sind hier 4-Ethylphenol, zusammen mit 4-Ethylguajacol und 4-Ethylcatechol. Die Wahrnehmungsschwelle von 4-Ethylphenol liegt bei 440 µg pro Liter. Die Substanz wird mit einem Lackgeruch, nach Pferdeschweiß riechend, phenolisch oder ledrig wahrgenommen.[9] Ende der 1960er-Jahre wurde 4-Ethylphenol zum ersten Mal von Albert Dinsmoor Webb und Mitarbeitern im Wein nachgewiesen.[10]
Biochemisch wird 4-Ethylphenol aus p-Cumarsäure in einem zweistufigen Prozess erzeugt.[11][9] Hierbei wird p-Cumarsäure zu Vinylphenol decarboxyliert und dann zu 4-Ethylphenol oxidiert. Die erste Reaktion wird von in Brettanomyces von einer Hydroxyzimtsäure-Decarboxylase, die zweite von einer Vinylphenolreduktase katalysiert.
Analytischer Nachweis
Mit Eisen(III)-chlorid bildet o-Ethylphenol eine blauviolette Färbung, m-Ethylphenol eine violette Färbung und p-Ethylphenol eine blaue Färbung. m-Ethylphenol bildet mit Essigsäureanhydrid ein flüssiges Acetat, das fruchtartig riecht und einen Siedepunkt von 222–223 °C hat.[6] Der qualitativ-analytische Nachweis kann auch über die leicht herstellbaren Benzoylderivate durchgeführt werden.
Einzelnachweise
- ↑ a b Datenblatt 2-Ethylphenol bei AlfaAesar, abgerufen am 16. August 2010 (JavaScript erforderlich).
- ↑ a b c d e Datenblatt 3-Ethylphenol bei Sigma-Aldrich, abgerufen am 3. Mai 2011.
- ↑ a b c d e f Datenblatt 4-Ethylphenol bei Sigma-Aldrich, abgerufen am 16. August 2010.
- ↑ a b c d e CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b c d Datenblatt 2-Ethylphenol bei Sigma-Aldrich, abgerufen am 16. August 2010.
- ↑ a b c d A. Béhal, E. Choay: "Sur les éthylphénols", in: Compt. Rend. Hebd., 1894, 118, S. 422–426; Volltext.
- ↑ Datenblatt 4-Ethylphenol bei Merck, abgerufen am 16. August 2010.
- ↑ Datenblatt 4-Ethylphenol bei Acros, abgerufen am 16. August 2010.
- ↑ a b Riccardo Flamini und Pietro Traldi: Mass Spectrometry in Grape and Wine Chemistry. John Wiley & Sons; 2010. ISBN 978-0-47039247-8; S. 145.
- ↑ Webb, AD. (1967): Wine flavor: Volatile aroma compounds of wines. In: H. W. Schultz (Hrsg), E. A. Day (Hrsg), L. M. Libbey (Hrsg): The chemistry and physiology of flavours. The AVI Publishing Company Inc., Westport Co.
- ↑ Brettanomyces Monitoring by Analysis of 4-ethylphenol and 4-ethylguaiacol at etslabs.com
Kategorien:- Gesundheitsschädlicher Stoff
- Reizender Stoff
- Stoffgruppe
- Phenol
Wikimedia Foundation.
