- Essigsäureanhydrid
-
Strukturformel 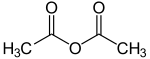
Allgemeines Name Essigsäureanhydrid Andere Namen - Acetanhydrid
- Ac2O
- Ethansäureanhydrid
Summenformel C4H6O3 CAS-Nummer 108-24-7 PubChem 7918 Kurzbeschreibung farblose, stechend riechende Flüssigkeit[1]
Eigenschaften Molare Masse 102,09 g·mol−1 Aggregatzustand flüssig
Dichte Schmelzpunkt Siedepunkt 139,4 °C[2]
Dampfdruck Löslichkeit - Zersetzung mit Wasser[2]
- löslich in Ethanol und Diethylether[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 


Gefahr
H- und P-Sätze H: 226-332-302-314 EUH: keine EUH-Sätze P: 280-301+330+331-305+351+338-309+310 [2] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Ätzend (C) R- und S-Sätze R: 10-20/22-34 S: (1/2)-26-36/37/39-45 MAK 5 ml·m−3, 21 mg·m−3[2]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Essigsäureanhydrid (Acetanhydrid) ist eine chemische Verbindung aus der Gruppe der Säureanhydride mit der Summenformel C4H6O3. Sie ist ein Essigsäurederivat, das durch die Kondensation zweier Essigsäuremoleküle entsteht. Dabei verbinden sich die Carboxygruppen zweier Moleküle Essigsäure unter Eliminierung von Wasser.
Inhaltsverzeichnis
Herstellung
Im Labor
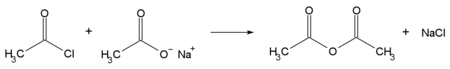
Im Labor kann Essigsäureanhydrid durch Reaktion eines Alkalisalzes der Essigsäure mit Acetylchlorid unter Abspaltung von Alkalichlorid-Salz, z. B. von Natriumchlorid, hergestellt werden:
Industrielle Herstellung
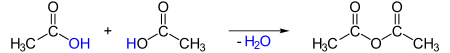
Die großtechnische Herstellung erfolgt durch Dehydratisierung (Wasserabspaltung) von Essigsäure bei 800 °C:
Bei der Synthese ist eine rasche Abkühlung und Trennung der Produkte notwendig, da andernfalls die Rückreaktion zu Essigsäure ablaufen kann.
Eine andere Möglichkeit bietet die Carbonylierung von Methylacetat nach dem Tennessee-Eastman-Verfahren. Ein Teil des Produktstroms wird mit Methanol wieder zum Methylacetat umgesetzt und wieder in den Prozess zurückgegeben. Die Synthese des Essigsäureanhydrids erfordert daher nur CO und Methanol. Als Katalysator dienen vor allem Rhodium- und Iridium-Komplexe. Die Umsetzung findet bei erhöhtem CO-Druck und Temperaturen um 200 °C statt.
Reaktionen
So wie andere Säureanhydride lässt sich auch Essigsäureanhydrid mit Alkoholen zu den entsprechenden Estern und mit Ammoniak bzw. mit Aminen zum entsprechenden Amid umsetzen.
Beim Einbringen in Wasser wird die Verbindung durch Hydrolyse in Essigsäure gespalten. Die Spaltung erfolgt in heißem Wasser wesentlich schneller als in kaltem Wasser.
Verwendung
Essigsäureanhydrid ist das kommerziell wichtigste aliphatische Anhydrid. Rund eine Million Tonnen werden pro Jahr produziert. Dabei wird es hauptsächlich für die Umsetzung mit Alkoholen zu Acetaten verwendet. Häufige Einsatzgebiete sind die Herstellung von Celluloseacetat und Acetylsalicylsäure sowie zur Absolutierung von Eisessig. Es ist zudem unabdingbar bei der Herstellung von Heroin, weswegen in vielen Ländern versucht wird, durch die Kontrolle des Zugangs zu Essigsäureanhydrid die Herstellung dieser halbsynthetischen Droge einzudämmen.
In der Synthesechemie wird Essigsäureanhydrid oft auch zum Aufbau von Schutzgruppen genutzt, das einen Alkohol in einen weniger reaktiven Ester überführt.
Diacetylperoxid, welches als Radikalbildner bei Polymerisationsreaktionen eingesetzt wird, lässt sich aus Essigsäureanhydrid und Natriummetaborat-peroxidhydrat herstellen.
Im Gemisch mit Schwefelsäure (9 Teile Essigsäureanhydrid auf 1 Teil Schwefelsäure) wird es zur Acetolyse verwendet.
Ferner wird Essigsäureanhydrid zur Acetylierung von Holz verwendet, eine Holzmodifikation zur Verbesserung der Eigenschaften (u.A. Feuchtigkeitsresistenz) von Nadelhölzern.
Einzelnachweise
- ↑ a b Roempp Online – Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e f g Eintrag zu CAS-Nr. 108-24-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 07.01.2008 (JavaScript erforderlich)
- ↑ a b Eintrag zu CAS-Nr. 108-24-7 im European chemical Substances Information System ESIS (ergänzender Eintrag)
Wikimedia Foundation.