- Antimon(V)-chlorid
-
Strukturformel 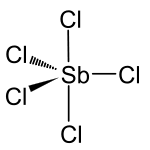
Allgemeines Name Antimon(V)-chlorid Andere Namen - Antimonpentachlorid
- Antimonsuperchlorid (veraltet)
Summenformel SbCl5 CAS-Nummer 7647-18-9 Kurzbeschreibung farblose bis gelbliche Flüssigkeit mit unangenehmem Geruch[1]
Eigenschaften Molare Masse 299,02 g·mol−1 Aggregatzustand flüssig
Dichte 2,336 g·cm−3[1]
Schmelzpunkt 2,8 °C[1]
Siedepunkt 76,5 °C (bei 28 mbar)[1]
Dampfdruck Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 

Gefahr
H- und P-Sätze H: 314-411 EUH: keine EUH-Sätze P: 273-280-301+330+331-305+351+338-309-310 [1] EU-Gefahrstoffkennzeichnung [1] 

Ätzend Umwelt-
gefährlich(C) (N) R- und S-Sätze R: 34-51/53 S: (1/2)-26-45-61 LD50 1120 mg·kg−1 (oral Ratte)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Antimon(V)-chlorid ist eine chemische Verbindung aus der Gruppe der Chloride.
Inhaltsverzeichnis
Geschichte
Antimon(V)-chlorid ist schon seit 1825 bekannt. Die Kristallstruktur konnte 1959 von Ohlberg aufgeklärt werden.[4]
Gewinnung und Darstellung
Antimon(V)-chlorid kann durch Reaktion von Chlorgas mit geschmolzenem Antimontrichlorid gewonnen werden[5]:
Eigenschaften
Antimon(V)-chlorid ist eine farblose bis gelbliche, an Luft rauchende Flüssigkeit mit unangenehmem Geruch. Unter Normaldruck verdampft die Verbindung ab 140 °C, wobei sie sich ab 70 °C zu Chlor und Antimontrichlorid zu zersetzen beginnt. Mit wenig Wasser entstehen die Hydrate SbCl5·H2O und SbCl5·4H2O.[5] Mit viel Wasser zersetzt es sich mit heftiger Reaktion.[1]
Antimon(V)-chlorid liegt bei –30 °C als Monomer vor und bildet eine trigonale Bipyramide. Es kristallisiert in der hexagonalen Raumgruppe P63/mmc mit den Gitterkonstanten a = 741,4 pm, b = 741,4 pm und c = 794,0 pm. Die Elementarzelle enthält dabei zwei Moleküle. Bei tiefen Temperaturen ab -55 °C bildet sich das doppelt chlorverbrückte Dimer Sb2Cl10 mit einer kantenverknüpften doppeloktaedrischen Struktur aus, was an einer Farbänderung von gelb nach orange sichtbar wird. Die Dimerisierungsenthalpie beträgt –1,8 kcal/mol.[4]
Verwendung
Antimon(V)-chlorid wird als Chlorierungsmittel bei organischen Synthesen verwendet, zudem ist es eine starke Lewis-Säure, die Chloridionen abstrahiert und dabei das Hexachloroantimonat-Ion bildet. In der Dünnschichtchromatographie dient eine Antimon(V)-chlorid-Lösung in Chloroform oder Tetrachlormethan als Anfärbereagenz.[6]
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu CAS-Nr. 7647-18-9 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. Juli 2010 (JavaScript erforderlich)
- ↑ Datenblatt Antimon(V)-chlorid bei Merck, abgerufen am 6. Juli 2010.
- ↑ Eintrag zu CAS-Nr. 7647-18-9 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ a b Haupt, Silvia; Pentahalogenide und Oxidhalogenide der Elemente der fünften Hauptgruppe, 2002
- ↑ a b Georg Brauer; Handbuch der präparativen anorganischen Chemie, Band 1, S. 588; ISBN 3-432-02328-6
- ↑ Helmut Sitzmann: Antimonchloride. In: Römpp Chemie-Lexikon. Thieme Verlag, Stand Dezember 2007.
Weblinks
Wikimedia Foundation.


