- Bariumacetat
-
Strukturformel 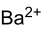
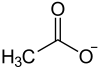
![\mathrm{ \ \!\ \Biggr]_2}](a/07a3843eb4b51c9bed598e32e34f28db.png)
Allgemeines Name Bariumacetat Summenformel C4H6BaO4 CAS-Nummer - 543-80-6 (Reinsubstanz)
- 5908-64-5 (Monohydrat)
Kurzbeschreibung weiße geruchlose Kristalle,[1]
Eigenschaften Molare Masse Aggregatzustand fest
Dichte Schmelzpunkt Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [5] 
Achtung
H- und P-Sätze H: 332-302 EUH: keine EUH-Sätze P: 261-264-301+312-304+340-312-501 [5] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [6] 
Gesundheits-
schädlich(Xn) R- und S-Sätze R: 20/22 S: (2)-28 LD50 921 mg·l−1 (oral, Ratte)[7]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bariumacetat ist das Bariumsalz der Essigsäure.
Inhaltsverzeichnis
Herstellung
Bariumacetat kann durch Reaktion von Bariumcarbonat oder Bariumsulfid mit Essigsäure dargestellt werden.[8]
Eigenschaften
Bariumacetat existiert in drei unterschiedlichen Kristallstrukturen: unterhalb von 24,7 °C als Trihydrat (CH3COO)2Ba · 3 H2O im monoklinen Kristallsystem, zwischen 24,7 °C und 41 °C als Monohydrat (CH3COO)2Ba · H2O im triklinen Kristallsystem und oberhalb von 41 °C in Form des wasserfreien Salzes.[2] Letzteres kristallisiert im tetragonalen Kristallsystem in der Raumgruppe I41/a mit den Gitterparametern a = 990,1 pm und b = 2736,2 pm. In der Elementarzelle befinden sich 16 Formeleinheiten.[9] Die Kristalle des Anhydrats sind nicht hygroskopisch.[4] Die Löslichkeitskurve hat in den Umwandlungspunkten deutliche Knicke.[10]
Die Standardbildungsenthalpie von Bariumacetat beträgt -1486 kJ/mol.[4]
Weblinks
Einzelnachweise
- ↑ a b c Datenblatt Bariumacetat bei AlfaAesar, abgerufen am 2. Juni 2010 (JavaScript erforderlich).
- ↑ a b Dale L. Perry, Sidney L. Phillips: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 45 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ a b Datenblatt Bariumacetat bei Merck, abgerufen am 2. Juni 2010.
- ↑ a b c Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 323 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ a b Eintrag zu CAS-Nr. 543-80-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. März 2011 (JavaScript erforderlich)
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Bariumsalze“; Eintrag in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Februar 2011 (JavaScript erforderlich)
- ↑ MSDS bei Gelest, INC.
- ↑ R. Abegg, F. Auerbach: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, Bd. 2, 1908. S. 287f.Volltext
- ↑ I. Gautier-Luneau, A. Mosset: "Crystal structure of anhydrous barium acetate" in Journal of Solid State Chemistry 1988, 73(2), S. 473-479. doi:10.1016/0022-4596(88)90133-8
- ↑ Georg Bredig, Wilhelm Bachmann: "Handbuch der angewandten physikalischen Chemie in Einzeldarstellungen, 1907. Verlag J.A. Barth, Band 5, S. 89. Volltext
Wikimedia Foundation.




