- Cadmiumhydroxid
-
Kristallstruktur 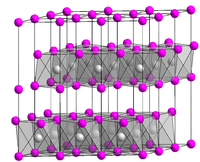
__ Cd2+ __ OH− Allgemeines Name Cadmiumhydroxid Andere Namen Cadmiumdihydroxid
Verhältnisformel Cd(OH)2 CAS-Nummer 21041-95-2 Kurzbeschreibung weißer Feststoff[1]
Eigenschaften Molare Masse 146,43 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Löslichkeit unlöslich in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 

Achtung
H- und P-Sätze H: 302-312-332-410 EUH: keine EUH-Sätze P: 273-280-501 [2] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 20/21/22-50-53 S: 60-61 MAK aufgehoben, da cancerogen[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Cadmiumhydroxid ist eine chemische Verbindung des Cadmiums aus der Gruppe der Hydroxide. Es ist fester, weißer Stoff, der sich bei ungefähr 300 °C zersetzt.
Inhaltsverzeichnis
Gewinnung und Darstellung
Cadmiumhydroxid entsteht durch Reaktion von Basen mit Cadmiumsalzlösungen und Ausfällung. Feinkristallines Cadmiumhydroxid kann nur durch Reaktion von Cadmiumnitratlösungen mit Natriumhydroxid erhalten werden.[4]
Hohe Konzentrationen an Halogenid-Ionen verhindern die Bildung von Cadmiumhydroxid, da sich das [CdX4]2−-Ion (X= F, Cl, Br, I) bildet.[4]
Eigenschaften
Cadmiumhydroxid kristallisiert im hexagonalen Kristallsystem mit der Raumgruppe
 mit den Gitterparametern a = 349,9 pm und c = 470,1 pm sowie einer Formeleinheit pro Elementarzelle. Die Struktur entspricht damit der Brucit-Struktur und ist eng verwandt mit der Cadmiumiodidstruktur.[5]
mit den Gitterparametern a = 349,9 pm und c = 470,1 pm sowie einer Formeleinheit pro Elementarzelle. Die Struktur entspricht damit der Brucit-Struktur und ist eng verwandt mit der Cadmiumiodidstruktur.[5]Cadmiumhydroxid ist im Vergleich zu Zinkhydroxid stärker basisch und löst sich daher nur in starken Basen. In [Ammoniak] ist es unter Bildung von Hexammin-Ionen [Cd(NH3)6]2+ löslich.[6]
Verwendung
Cadmiumhydroxid dient als Anodenmaterial entladener Nickel-Cadmium-Akkumulatoren. In der Anodenfertigung wird es durch Oxidation von metallischem Cadmium durch Wasserstoffperoxid auf dem Trägermaterial erzeugt. Auch entsteht es während des Entladungsvorganges dieser Akkumulatoren, beim Laden wird es zu Cadmium reduziert.[7]
Für die Gewinnung anderer Cadmiumverbindungen ersetzt es häufiger Cadmiumoxid.[4]
Einzelnachweise
- ↑ a b c d e Datenblatt Cadmiumhydroxid bei AlfaAesar, abgerufen am 1. September 2010 (JavaScript erforderlich)..
- ↑ a b Datenblatt Cadmiumhydroxid bei Sigma-Aldrich, abgerufen am 15. März 2011.
- ↑ Nicht explizit in RL 67/548/EWG, Anh. I gelistet, fällt aber dort mit der angegebenen Kennzeichnung unter den Sammelbegriff „Cadmiumverbindungen“; Eintrag in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31. März 2009 (JavaScript erforderlich)
- ↑ a b c Karl-Heinz Schulte-Schrepping, Magnus Piscator: Cadmium and Cadmium compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2002, doi:10.1002/14356007.a04 499.
- ↑ Jean D'Ans, Ellen Lax: Taschenbuch Fur Chemiker und Physiker: Band 3: Elemente, Anorganische Verbindungen und Materialien, Minerale. 3. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 1374 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Gerd Blumenthal, Dietmar Linke, Siegfried Vieth: Chemie: Grundwissen für Ingenieure. Vieweg+Teubner Verlag, 2006, ISBN 978-3-5190-3551-0, S. 356 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Karl-Heinz Lautenschläger, Werner Schröter: Taschenbuch der Chemie. 20. Auflage, Harri Deutsch Verlag, 2007, ISBN 978-3-8171-1761-1, S. 379 (Eingeschränkte Vorschau in der Google Buchsuche).
Wikimedia Foundation.

