- Fluorethen
-
Strukturformel 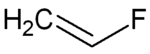
Allgemeines Name Fluorethen Andere Namen - Vinylfluorid
- Fluorethylen
- Monofluorethen
- VF
Summenformel C2H3F CAS-Nummer 75-02-5 PubChem 6339 Kurzbeschreibung hochentzündliches, farbloses Gas mit etherischem Geruch[1]
Eigenschaften Molare Masse 46,04 g·mol−1 Aggregatzustand gasförmig
Dichte 0,775 g·cm−3[1]
Schmelzpunkt −160,5 °C[1]
Siedepunkt −72,2 °C[1]
Dampfdruck Löslichkeit wenig löslich in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 



Gefahr
H- und P-Sätze H: 220-280-341-350-336-371 EUH: keine EUH-Sätze P: ? EU-Gefahrstoffkennzeichnung [1] 
Hoch-
entzündlich(F+) R- und S-Sätze R: 12 S: 9-16-33 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Fluorethen ist eine chemische Verbindung aus der Gruppe der aliphatischen ungesättigten Halogenkohlenwasserstoffe und organischen Fluorverbindungen.
Inhaltsverzeichnis
Gewinnung und Darstellung
Fluorethen wurde 1901 erstmalig durch Frédéric Swarts synthetisiert. Swarts nutzte dabei die Reaktion von Zink mit 1,1-Difluor-2-bromethan. Heute wird es industriell auf zwei Wegen hergestellt. Erstens durch Reaktion von Ethin und Fluorwasserstoff mit Quecksilberverbindungen oder Aluminium-, Zinn- oder Zinkfluoriden als Katalysator:[3][4]
Und zweitens durch katalytische Dehydrofluorination bzw. Dechlorination von 1,1,1-Trifluorethan oder 1,1-Chlorfluorethan:
Es wird durch die U.S. Environmental Protection Agency (EPA) als high production chemical eingestuft, was bedeutet, dass die Produktionsmenge 1990 mehr als eine Million Pfund betrug. [5] 1999 wurden weltweit mehr als 33.000 Tonnen produziert.[6]
Eigenschaften
Fluorethen ist ein hochentzündliches, farbloses Gas mit etherischem Geruch. Es ist schwerer als Luft und wenig löslich in Wasser. Es ist chemisch instabil und neigt zur Polymerisation. In Druckgasflaschen liegt es in verflüssigter Form vor. Beim Ausströmen der Flüssigkeit oder beim Entweichen großer Gasmengen bilden sich Nebel, die sich am Boden ausbreiten. Es besitzt eine kritische Temperatur von 54,73 °C, einen kritischen Druck von 51,12 bar, einen kritische Dichte von 0,322 kg/l und eine Tripelpunkt-Temperatur (Schmelztemperatur) von -160,5 °C.[1]
Verwendung
Fluorethen wird zur Herstellung von Polyvinylfluorid (PVF) und zur Copolymerisation mit Chlortrifluorethylen und Hexafluorpropylen verwendet.[1] Es wurde früher unter der Bezeichnung R1141 als Kältemittel eingesetzt.
Sicherheitshinweise
Die Dämpfe von Fluorethen können mit Luft ein explosionsfähiges Gemisch (Zündtemperatur 375 °C) bilden.[1] Es besteht der Verdacht einer krebserzeugenden Wirkung.[5]
Verwandte Verbindungen
- Vinylidenfluorid
- Vinylchlorid
- Vinylbromid
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu CAS-Nr. 75-02-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Juli 2010 (JavaScript erforderlich)
- ↑ Safety Data Sheet of Vinyl fluoride
- ↑ Günter Siegemund, Werner Schwertfeger, Andrew Feiring, Bruce Smart, Fred Behr, Herward Vogel, Blaine McKusick “Fluorine Compounds, Organic” Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. doi:10.1002/14356007.a11_349
- ↑ Hans-Jürgen Arpe; Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte, S.246ff; ISBN 978-3-527-31540-6
- ↑ a b Vinyl Fluoride (National Toxicology Program)
- ↑ 1,1’-DIFLUOROETHYLENE (inchem)
Wikimedia Foundation.


