- Lithiumformiat
-
Strukturformel 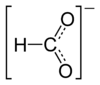
Allgemeines Name Lithiumformiat Andere Namen Lithiummethanoat
Summenformel CHLiO2 CAS-Nummer - 556-63-8 (Reinsubstanz)
- 6108-23-2 (Monohydrat)
PubChem 23702287 Kurzbeschreibung weißes kristallines Pulver[1]
Eigenschaften Molare Masse Aggregatzustand fest
Dichte 1,46 g·cm−3 (20 °C)[1] (Monohydrat)
Schmelzpunkt Löslichkeit löslich in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 
Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [2] EU-Gefahrstoffkennzeichnung [1] 
Reizend (Xi) R- und S-Sätze R: 36/37/38 S: 26-37 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Lithiumformiat ist das Lithiumsalz der Ameisensäure. Es ist im Handel als Monohydrat in Form von weißen Kristallen mit der stöchiometrischen Zusammensetzung HCOOLi · H2O erhältlich.
Inhaltsverzeichnis
Gewinnung und Darstellung
Lithiumformiat kann durch Salzbildungsreaktion aus Lithiumhydroxid und Ameisensäure hergestellt werden.
Ebenso ist die Synthese aus Lithiumcarbonat und Ameisensäure unter Entwicklung von Kohlendioxid möglich.[3]
Eigenschaften
Lithiumformiat kristallisiert im orthorhombischen Kristallsystem[4] in der Raumgruppe Pna21 mit den Gitterparametern a = 699 pm, b = 650 pm und c = 485 pm. In der Elementarzelle befinden sich vier Formeleinheiten.[5]
Das Monohydrat geht bei 94 °C unter Wasserabspaltung in das Anhydrid über.[6] Bei weiterem Erhitzen zersetzt sich Lithiumformiat bei 230 °C[5] unter Bildung von Lithiumcarbonat, Kohlenmonoxid und Wasserstoff.[3]
Sicherheitshinweise
Große Mengen von Lithiumformiat haben wie alle wasserlöslichen Lithiumsalze eine toxische Wirkung auf das zentrale Nervensystem. Bei wiederholter Einnahme können auch die Nieren geschädigt werden.[7]
Einzelnachweise
- ↑ a b c d e Datenblatt Lithiumformiat bei AlfaAesar, abgerufen am 26.Mai 2010 (JavaScript erforderlich).
- ↑ a b Datenblatt Lithium formate monohydrate bei Sigma-Aldrich, abgerufen am 8. April 2011.
- ↑ a b T. Meisel, Z. Halmos, K. Seybold, E. Pungor: "The thermal decomposition of alkali metal formates" in Journal of Thermal Analysis and Calorimetry 1975, 7(1). S. 73-80. doi:10.1007/BF01911627
- ↑ R. Abegg, F. Auerbach, I. Koppel: "Handbuch der anorganischen Chemie". Verlag S. Hirzel, 1908. S. 149.Volltext.
- ↑ a b Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-5406-0035-0, S. 532 (Eingeschränkte Vorschau in der Google Buchsuche).
- ↑ Erich Groschuff: "Neutrale und saure Alkaliformiate. Studien über die Löslichkeit der Salze. XI." in Berichte der deutschen chemischen Gesellschaft 1903, 36(2), S. 1783-1795 doi:10.1002/cber.19030360276.
- ↑ MSDS bei Strem Chemicals.
Kategorien:- Reizender Stoff
- Lithiumverbindung
- Formiat
Wikimedia Foundation.



