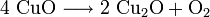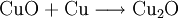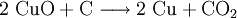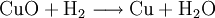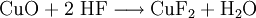- CuO
-
Kristallstruktur Keine Kristallstruktur vorhanden Allgemeines Name Kupfer(II)-oxid Andere Namen Kupfermonoxid, Cuprum oxydatum, Cuprioxyd
Verhältnisformel CuO CAS-Nummer 1317-38-0 Kurzbeschreibung schwarzer, amorpher oder kristalliner Feststoff [1] Eigenschaften Molare Masse 79,545 g·mol−1 Aggregatzustand fest
Dichte 6,48 g·cm−3 [1]
Schmelzpunkt 1326 °C [1]
Siedepunkt thermische Zersetzung: 1026 °C [1]
Löslichkeit unlöslich in Wasser und Alkoholen, löslich in verdünnten Säuren, löslich in Ammoniumhydroxid
Sicherheitshinweise Gefahrstoffkennzeichnung [1] 

Gesundheits-
schädlichUmwelt-
gefährlich(Xn) (N) R- und S-Sätze R: 22-50/53 S: 22-61 MAK 0,1 mg·m−3 (gemessen als einatembarer Aerosolanteil)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Kupfer(II)-oxid ist eine chemische Verbindung, die Kupfer und Sauerstoff enthält. In diesem Oxid mit der Summenformel CuO ist Kupfer zweiwertig. Kupfer(II)-oxid ist ein schwarzer, amorpher oder kristalliner Feststoff.
Inhaltsverzeichnis
Vorkommen
In der Natur kommt Kupfer(II)-oxid als das Mineral Tenorit vor. Tenorit entsteht bei der Verwitterung von Kupfersulfiden und findet sich daher üblicherweise in oxidierten Teilen von Kupfervorkommen. Das Mineral ist nach dem italienischen Botaniker Michele Tenore (*1780; †1861) benannt.
Gewinnung und Darstellung
Kupfer(II)-oxid kann durch thermische Zersetzung (Pyrolyse) von Kupfer(II)-nitrat oder Kupfer(II)-carbonat dargestellt werden.
Kupfer(II)-oxid kann auch durch Erwärmen von (frisch gefälltem) Kupfer(II)-hydroxid hergestellt werden. Das Kupfer(II)-hydroxid wird durch Zugabe von Alkalihydroxiden zu einer Cu(II)-Salzlösung ausgefällt.
Kupfer(II)-oxid bildet sich zusammen mit Kupfer(I)-oxid beim Erhitzen von metallischem Kupfer auf Rotglut an Luft.
Eigenschaften
Kupfer(II)-oxid ist unlöslich in Wasser und Alkoholen. Dagegen ist es in verdünnten Säuren löslich. Durch Eindampfen können die entsprechenden Kupfer(II)-salze erhalten werden. Kupfer(II)-oxid ist unter Komplexbildung in Ammoniumhydroxid löslich.
Kupfer(II)-oxid adsorbiert leicht Sauerstoff, Stickstoff, Kohlendioxid und andere Gase.
Beim Erhitzen über etwa 800 °C wird Kupfer(II)-oxid unter Sauerstoffabgabe zu Kupfer(I)-oxid umgewandelt.
Werden metallisches Kupfer und Kupfer(II)-oxid zusammen erhitzt entsteht ebenfalls Kupfer(I)-oxid.
Kupfer(II)-oxid wird bei erhöhter Temperatur durch verschiedene Reduktionsmittel (beispielsweise Kohlenstoff, Kohlenmonoxid,Wasserstoff) zu metallischem Kupfer reduziert.
Beim Erhitzen von Kupfer(II)-oxid mit Fluorwasserstoff auf 400 °C wird Kupfer(II)-fluorid gebildet.
Verwendung
Kupfer(II)-oxid wird als Pigment zum Färben von Glas, Keramik, Porzellan und künstlichen Edelsteinen verwendet. Daneben findet es Anwendung als Kathodenmaterial in Batterien, als Katalysator, zur Entschwefelung von Erdöl und für fäulnishemmende Anstriche. Kupfer(II)-oxid wird auch als Ausgangsstoff für die Herstellung von verschiedenen Kupferverbindungen genutzt. Seit der Entdeckung der Supraleitung von Verbindungen von La2CuO4 (dotiert mit Strontium) und der nachfolgenden Entdeckung von weiteren über hundert ähnlichen Verbindungen, die zum größten Teil nicht ohne Kupfer und Sauerstoff auskommen, wird Kupfer-II-Oxid auch für die keramischen Supraleiter verwendet, die als zukunftsträchtige Materialien gelten.
Quellen
- ↑ a b c d e f Eintrag zu CAS-Nr. 1317-38-0 in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 30. März 2007 (JavaScript erforderlich)
Weblinks
Wikimedia Foundation.

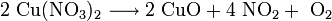
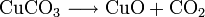
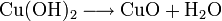
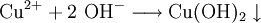
-oxid.jpg)