- Arinmechanismus
-
Als Arinmechanismus bezeichnet man in der organischen Chemie einen speziellen Reaktionstypus, welcher formal zur sogenannten nukleophilen aromatischen Substitution gehört. Tatsächlich handelt es sich um einen, mehr oder weniger ausgeprägten, zweistufigen Mechanismus (Eliminierung, Addition). Kennzeichnend für die Reaktion ist das Auftreten einer Arinzwischenstufe. Als Arin oder auch Dehydrobenzen bezeichnet man einen Benzolring, der eine Dreifachbindung aufweist.
Die Entdeckung der Arin-Zwischenstufe
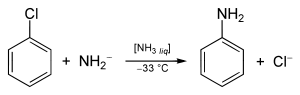
Das Postulat einer Arinzwischenstufe wurde anhand einer Reihe von Experimenten mit Chlorbenzol (C6H5Cl) aufgestellt. Chlorbenzol, ein recht elektronenreicher Aromat (+M-Effekt des Chlors), erweist sich gegenüber den meisten Nucleophilen wie etwa dem Hydroxidion (OH–) als sehr reaktionsträge; es sind Temperaturen von über 200 °C nötig, um überhaupt eine Reaktion zu generieren. Mit Natriumamid NaNH2 in flüssigem Ammoniak wird Chlorbenzol bei −33 °C jedoch in Anilin umgewandelt.
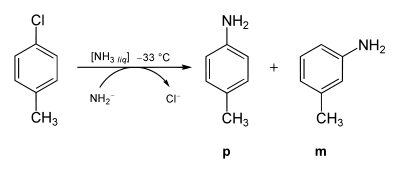
Betrachtet man als Ausgangsverbindung nicht Chlorbenzol, sondern para-Chlortoluol (p-CH3C6H4Cl) und setzt sie mit denselben Bedingungen wie beim Chlorbenzol mit Amidionen um, so findet man zwei Produkte: ein erwartetes Amino-Substitutionsprodukt und ein unerwartetes. Somit kann das Chloratom nicht direkt durch die Aminogruppe substituiert worden sein. Zusätzlich findet man bei der Umsetzung von Chlortoluol mit Amid-Ionen immer nur die meta- und die para-Aminoprodukte, niemals aber das ortho-Isomer.
Reaktionsmechanismus
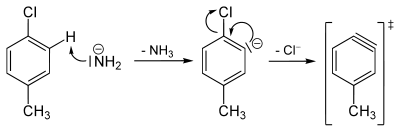
Bekannt aus H/D-Austauschreaktionen ist, dass das Amid-Anion in flüssigem Ammoniak Protonen aus Benzol abstrahieren kann. Besonders rasch geht dieses in o-Stellung zu (−I)-Substituenten, wie z. B. Chlor. Aus diesen Tatsachen lässt sich schließen, dass primär nicht das chlorsubstituierte Kohlenstoffatom des Aromaten angegriffen wird. Das Amidion deprotoniert als starke Base ein alpha-Wasserstoffatom des Chlortoluols, was über ein Carbanion zu einer Dreifachbindungs-Zwischenstufe, dem Arin, führt.
Bei der folgenden Addition von NH3 bildet sich sowohl das m-Isomer, als auch das p-Isomer.
2,6–Dimethylchlorbenzol reagiert unter diesen Bedingungen nicht zum entsprechenden Anilin-Derivat. 2,6–Dimethylchlorbenzol hat keine alpha-Wasserstoffatome. Somit kann kein Proton abstrahiert werden, das Arin bildet sich nicht aus.
Die Existenz des einfachsten Arins – Dehydrobenzol – kann bei Niedrigtemperaturen spektroskopisch nachgewiesen werden. Erzeugt man ein Arin in Gegenwart von Furan, entsteht das entsprechende Diels-Alder-Produkt. Fehlen geeignete Abfangreagenzien dimerisiert Dehydrobenzol zum entsprechenden, stabilen Biphenylen.
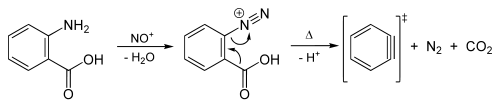
Ein Arin lässt sich auch gezielt aus diazotierter Anthranilsäure erzeugen, wenn sich diese thermisch zersetzt:
Literatur
- Hans Peter Latscha, Uli Kazmaier und Helmut Alfons Klein: Organische Chemie: Chemie-Basiswissen II. Springer Verlag Berlin; 5. Auflage 2002; ISBN 3-540-42941-7; S. 119f.
- Peter Sykes: Wie funktionieren organische Reaktionen? 2. Auflage, Wiley-VCH 2001, ISBN 3-527-30305-7.
- Peter Sykes: Reaktionsmechanismen der Organischen Chemie 7. Auflage, Verlag Chemie 1979, ISBN 3-527-21047-4.
Wikimedia Foundation.