- Dimethylcarbonat
-
Strukturformel 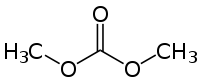
Allgemeines Name Dimethylcarbonat Andere Namen - DMC
- Methylcarbonat
- Kohlensäuredimethylester
Summenformel C3H6O3 CAS-Nummer 616-38-6 Kurzbeschreibung farblose Flüssigkeit[1]
Eigenschaften Molare Masse 90,08 g·mol–1 Aggregatzustand flüssig
Dichte 1,07 g·cm−3 (20 °C)[1]
Schmelzpunkt Siedepunkt 90 °C (1016 hPa)[1]
Dampfdruck Löslichkeit 139 g·l−1 (20 °C) in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [2] 
Gefahr
H- und P-Sätze H: 225 EUH: keine EUH-Sätze P: 210-233-240-243-403+235 [3] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 
Leicht-
entzündlich(F) R- und S-Sätze R: 11 S: (2)-9-16 LD50 9000 mg·kg−1 (Ratte, oral)[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Dimethylcarbonat ist eine organische chemische Verbindung, die als Dimethylester der Kohlensäure gesehen werden kann.
Inhaltsverzeichnis
Darstellung und Gewinnung
Dimethylcarbonat kann in einer Zweiphasenreaktion durch Umsetzung von Methanol mit Phosgen oder Methylchlorformiat in konzentrierter Natronlauge gewonnen werden.[4] Eine modernere Synthese verläuft als direkte oxydative Carbonylierung von Methanol mittels Kohlenmonoxid und Sauerstoff in Gegenwart von Kupferkatalysatoren.[5][6].
Eigenschaften
Dimethylcarbonat ist eine leichtentzündliche, farblose Flüssigkeit. Bei Normaldruck siedet die Verbindung bei 90 °C.[7] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 11,7067, B = 2158,837 und C = −153,531 im Temperaturbereich von 310 K bis 364 K.[7] Der kritische Punkt wird bei einer Temperatur Tc = 284 °C und einem Druck Pc = 48 bar mit einer kritischen Dichte von 3,97 mol·l−1 erreicht.[8] Es besitzt einen Flammpunkt von 14 °C und eine Zündtemperatur von 458 °C. Zwischen 4,22 und 12,87 Vol% bildet sie mit Luft explosive Gemische.[1]
Verwendung
Im Gemisch mit Ethylencarbonat wird die Verbindung in nichtwäßrigen Elektrolytlösungen für Lithiumbatterien verwendet.[9] In der organischen Synthese wird Dimethylcarbonat als Methylierungsreagenz eingesetzt. Außerdem ersetzt es zunehmend das sehr giftige Phosgen bei der Herstellung von Polycarbonat-Kunststoffen.[10]
Einzelnachweise
- ↑ a b c d e f g h Datenblatt Dimethylcarbonat bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b Eintrag zu CAS-Nr. 616-38-6 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Eintrag zu CAS-Nr. 616-38-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. März 2011 (JavaScript erforderlich).
- ↑ Buysch, H.-J.; Krimm, H.; Böhm, H.: EP21211 (Bayer 1979).
- ↑ Cassar, L.: Chim. Ind. Milan 72 (1990) S. 18.
- ↑ Romano, U.; Rivetti, F.: Europäisches Patent 365 083 A1 (Enichem Synth. 1988).
- ↑ a b Yan Xing, Dongbei Shao, Wenjun Fang, Yongsheng Guo, Tuisen Lin: Vapor pressures and flash points for binary mixtures of tricyclo[5.2.1.02.6]decane and dimethyl carbonate in Fluid Phase Equilibria 284 (2009) S. 14–18. doi:10.1016/j.fluid.2009.06.002.
- ↑ Steele, W.V.; Chirico, R.D.; Knipmeyer, S.E.; Nguyen, A.: Vapor Pressure, Heat Capacity, and Density along the Saturation Line, Measurements for Dimethyl Isophthalate, Dimethyl Carbonate, 1,3,5-Triethylbenzene, Pentafluorophenol, 4-tert-Butylcatechol, α-Methylstyrene, and N,N‘-Bis(2-hydroxyethyl)ethylenediamine in J. Chem. Eng. Data 42 (1997) S. 1008–1020. doi:10.1021/je970102d.
- ↑ Ding, M.S.; Xu, K.; Jow, T.R.: J. Electrochem. Soc. 147 (2000) S. 1688.
- ↑ Verband der chemischen Industrie: Positionen zur Chemie mit Chlor.
Wikimedia Foundation.
