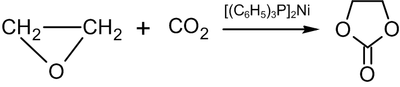- Ethylencarbonat
-
Strukturformel 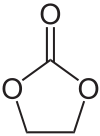
Allgemeines Name Ethylencarbonat Andere Namen 1,3-Dioxolan-2-on
Summenformel C3H4O3 CAS-Nummer 96-49-1 PubChem 7303 Kurzbeschreibung farblose Kristalle[1]
Eigenschaften Molare Masse 88,06 g·mol−1 Aggregatzustand fest
Dichte 1,32 g·cm−3 (40 °C)[2]
Schmelzpunkt Siedepunkt 248 °C (Zersetzung)[2]
Dampfdruck Löslichkeit Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [3] 
Achtung
H- und P-Sätze H: 315-319-335 EUH: keine EUH-Sätze P: 261-305+351+338 [3] EU-Gefahrstoffkennzeichnung [2] 
Reizend (Xi) R- und S-Sätze R: 41 S: 26-39 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Ethylencarbonat, korrekt auch als 1,3-Dioxolan-2-on bezeichnet, ist eine farblose und fast geruchlose, bei Raumtemperatur feste Verbindung.
Inhaltsverzeichnis
Eigenschaften und Synthese
Sie besteht aus drei Kohlenstoff-, vier Wasserstoff- und drei Sauerstoff-Atomen, wovon zwei als zweifache Estergruppe (R–O–CO–O–R) mit zwei Kohlenstoffatomen einen Fünfring bilden. Ethylencarbonat ist damit als cyclischer Ester aus Kohlensäure und Ethylenglycol aufzufassen, wird aber aus Ethylenoxid und Kohlenstoffdioxid (CO2) hergestellt.
Verwendung
Ethylencarbonat wird in der chemischen Industrie als Ausgangsstoff für Synthesen und als Lösungsmittel bei höheren Temperaturen verwendet. So dient sie als
- Hochtemperatur-Lösungsmittel bei der Verspinnung von Polynitril-Fasern
- Ausgangsprodukt für die Synthese von Oxazolidinonen, Imidazolidonen, Pyrimidinen und Purinen
- Komponente in Elektrolytlösungen für Lithium-Batterien
Literatur
- CD Roempp Chemie Lexikon, Stuttgart, Georg Thieme Verlag
- Produktinformationen von Lemro
Einzelnachweise
- ↑ a b Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e f Datenblatt Ethylencarbonat bei Merck, abgerufen am 19. Januar 2011.
- ↑ a b Datenblatt Ethylene carbonate bei Sigma-Aldrich, abgerufen am 31. März 2011.
Siehe auch
Wikimedia Foundation.