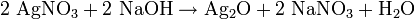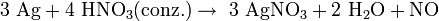- AgNO3
-
Strukturformel 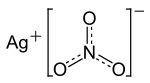
Allgemeines Name Silbernitrat Andere Namen - Salpetersaures Silber
- Silbersalpeter
- Höllenstein
- Lapis Infernalis
Summenformel AgNO3 CAS-Nummer 7761-88-8 PubChem 24470 ATC-Code D08AL01
Kurzbeschreibung geruch- und farblose Kristalle Eigenschaften Molare Masse 169,87 g·mol−1 Aggregatzustand fest
Dichte Schmelzpunkt Siedepunkt 440 °C (thermische Zersetzung)[1]
Löslichkeit leicht löslich in Wasser (2160 g/l bei 20 °C[1]), schlecht löslich in Ethanol
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2]
O
Brandfördernd
C
Ätzend
N
Umwelt-
gefährlichR- und S-Sätze R: 8-34-50/53 S: (1/2)-26-36/37/39-45-60-61 Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln MAK 0,01 mg·m−3[1]
WGK 3 [1] Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Silbernitrat (trivial: Höllenstein, lateinisch: Lapis infernalis) ist ein Salz der Salpetersäure. Es ist zusammengesetzt aus dem Kation Ag+ und dem Nitratanion NO3−.
Inhaltsverzeichnis
Eigenschaften
Silbernitrat, AgNO3, bildet farblose, tafelförmige Kristalle. Es ist sehr leicht in Wasser und schwer in Ethanol löslich. Silbernitrat hat einen Schmelzpunkt von 209 °C, bei Erhitzen auf etwa 440 °C erfolgt Zersetzung unter Abscheidung von metallischem Silber und Abgabe nitroser Gase. Es muss gut verschlossen und vor Licht geschützt (beispielsweise in braunen Glasflaschen) gelagert werden, da bereits geringe Staubmengen ausreichen, um Silbernitrat unter Lichteinwirkung zu feinverteiltem Silber zu reduzieren. Sehr reines Silbernitrat ist dagegen nicht lichtempfindlich. Silbernitrat bildet mit Chlorid-, Bromid-, Iodid- und Sulfidionen schwerlösliche Niederschläge.
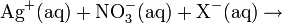
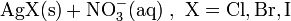
- Gibt man Silbernitratlösung zu einer wässrigen Halogenidlösung, fällt festes weißes Silberhalogenid aus, Nitrat bleibt in Lösung.
Mit Basen (z.B. Natriumhydroxid) bildet sich Silber(I)-oxid:[3]
Silbernitrat denaturiert Eiweiß durch Bildung von Silbersalzen der Eiweiße (z. B. Silberalbuminat), in Lösungen flocken diese aus. Bei Hautkontakt bilden sich daher rasch schwarze Flecken.
Verwendung
Silbernitrat-Lösung ist ein Nachweisreagenz für Halogenide (Cl−-, Br−-, I−-Ionen) und Pseudohalogenide und wird zu deren quantitativen Bestimmung in der Titration nach Mohr verwendet. Fluoridionen (F−) lassen sich durch Niederschlag nicht nachweisen, da Silber(I)-fluorid als einziges Silberhalogenid gut wasserlöslich ist.
Silbernitrat dient auch zum Nachweis von Aldehydgruppen und Proteinen. In der Proteinbiochemie wird Silbernitrat zum Anfärben von Proteinen verwendet, die in einem Polyacrylamid-Gel aufgetrennt wurden. In der Histologie kommt Silbernitrat zur Färbung von Gewebeschnitten, beispielsweise bei der Golgi-Cox-Methode, zum Einsatz. In der Kriminaltechnik (Daktyloskopie) wird eine Silbernitrat-Methanol-Lösung zur Sichtbarmachung von Fingerabdrücken benutzt.
Es ist Ausgangsstoff zur Darstellung anderer Silbersalze, besonders der Silberhalogenide, die in der Fotografie verwendet werden. Es dient zur galvanischen Versilberung, zur Herstellung von Silberspiegeln und als Haarfärbemittel.
In der Medizin kommt Silbernitrat als Antiseptikum und Adstringens (als 0,5-%ige Lösungen zur lokalen Behandlung) und als Ätzmittel („Höllenstein-Ätzstift“, Österreich: "Lapisstift") gegen Hautwucherungen, Geschwüre und Warzen zur Anwendung. Bis vor einigen Jahren noch wurde Neugeborenen eine 1-%ige Silbernitratlösung in die Augen getropft um eine gonorrhoeische Augeninfektion zu verhindern (Credé-Prophylaxe). Heute wird stattdessen ein Antibiotikum gegeben, welches nicht in den Augen schmerzt und gegen mehrere unterschiedliche Keime gleichzeitig wirkt. Auf Grund der zunehmenden Antibiotika-Resistenz besteht heute die Tendenz, das Silbernitrat erneut einzusetzen.
In der Homöopathie wird Silbernitrat angewendet bei extremer Angst (Gesundheit, Tod, Eile, Impulsivität, Nervosität, Prüfungsangst, Heiserkeit, Durchfall); siehe (Liste homöopathischer Grundsubstanzen).
Herstellung
Die Herstellung erfolgt durch Reaktion von Silber mit Salpetersäure unter Bildung nitroser Gase:
oder durch die Reaktion von Salpetersäure mit Silberoxid ohne Bildung nitroser Gase.
Quellen
- ↑ a b c d e f Eintrag zu Silbernitrat in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 3. September 2007 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 7761-88-8 im European chemical Substances Information System ESIS
- ↑ Campaigne, E.; LeSuer, W. M. (1963). "3-Thiophenecarboxylic (Thenoic) Acid". Org. Synth.; Coll. Vol. 4: 919. (preparation of Ag2O, used in oxidation of an aldehyde)
Weblinks
Wikimedia Foundation.