- Erregungsleitung
-
Die Ausbreitung einer Erregung in und auf andere Zellen im Organismus wird als Erregungsleitung bezeichnet. Der häufig verwendete Begriff „Reizleitung“ ist falsch, da ein Reiz nicht weitergeleitet werden kann, lediglich die durch ihn verursachte Erregung. Ein Reiz erzeugt eine Erregung in Rezeptoren und diese Erregung wird über Nervenzellen zum Erfolgsorgan geleitet. Innerhalb der Zelle geschieht die Erregungsleitung über verkettete Fließgleichgewichte. Dabei verläuft die Erregung nur durch Teile eines Neurons, die Kompartimente. Bei 20 000 Synapsen leitet also ein Neuron entsprechend viele Erregungen durch.
Zwischen den Nervenzellen erfolgt die Weiterleitung über Neurite (Axone) entweder durch Ionenflüsse (elektrotonisch, siehe Elektrotonus) oder mittels Aktionspotentialen.
Inhaltsverzeichnis
Grundlagen
Vereinfacht kann ein Axon als ein langer Zylinder betrachtet werden, der aus einer Aneinanderreihung von Segmenten besteht. Die Wand jedes dieser Segmente wird durch die Lipiddoppelschicht der Axonmembran gebildet, deren elektrische Eigenschaften sich als die Parallelschaltung eines elektrischen Widerstandes rm und eines Kondensators mit der Kapazität cm beschreiben lassen. Der Widerstand der Membran ist dabei in unerregtem Zustand so groß, dass die Lipiddoppelschicht die Funktion eines Dielektrikums erfüllt, so dass durch die elektrostatischen Kräfte, die über die Membran zwischen Intra- und Extrazellulärraum wirksam sind, eine Kapazität cm entsteht. Sie ist proportional zur Oberfläche der Membran und umgekehrt proportional zu ihrer Dicke.
Membranzeitkonstante
Ist das Axon nicht erregt, besitzt es ein Ruhemembranpotential von ca. -90mV, das heißt zwischen den beiden Platten des Kondensators herrscht eben diese Potentialdifferenz. Während einer Depolarisation ändert sich nun das Membranpotential, wobei der Kondensator entladen, oder sogar umgeladen werden muss, je nachdem ob die Potentialdifferenz positiv wird. Die für diesen Vorgang benötigte Zeit lässt sich mit Hilfe der Membranzeitkonstante τ ermitteln und errechnet sich als Produkt aus dem Membranwiderstand rm und der Membrankapazität cm:
 .[1]
.[1]
Sie gibt die Zeit in Sekunden an, nach der die Amplitude der Potentialdifferenz auf 36,8% des Ausgangswertes abgesunken ist. Sie ist damit ein Maß für die Geschwindigkeit der Potentialänderung. Da dieser Vorgang der eigentlich zeitaufwändige bei der Fortleitung einer Erregung ist und er an jedem Membranabschnitt, der depolarisiert wird, wiederholt werden muss, ist ersichtlich, dass die Erregungsleitung beschleunigt werden kann, wenn die Membranzeitkonstante selbst, oder die Häufigkeit mit der ein Aktionspotential erneuert werden muss, verringert wird. Letzteres wird durch eine Erhöhung der im Folgenden beschriebenen Membranlängskonstante ermöglicht.
Membranlängskonstante
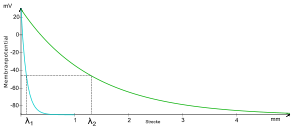
Zusätzlich zum Längswiderstand besitzt jedes Axon außerdem einen Membranwiderstand rm. Zusammen mit dem Längswiderstand rl errechnet sich daraus eine Membranlängskonstante λ. Sie gibt die Strecke entlang eines Axons an, nach der die Amplitude des Potentials auf 36,8% abgefallen ist. Daraus lässt sich ableiten, dass die Strecke, nach welcher ein an einem Ort ausgelöstes Aktionspotential durch Öffnung spannungsabhängiger Kationenkanäle noch in der Lage ist erneut ein Aktionspotential auszulösen umso größer ist, je größer die Membranlängskonstante ist. Gemäß der obigen Gleichung lässt sie sich einerseits durch eine Steigerung des Membranwiderstandes erhöhen. Im menschlichen Organismus passiert dies durch eine Isolierung des Axons durch Myelinisierung, wodurch das Auftreten von Leckströmen reduziert, und so der Verlust der Ladungsträger, die für die Ausbildung der Potentialdifferenz verantwortlich sind, minimiert wird. Andererseits lässt sich die Membranlängskonstante durch eine Erniedrigung des Längswiderstandes erhöhen. Er verhält sich umgekehrt proportional zur Querschnittsfläche des Axons: eine Verdopplung des Axondurchmessers führt zu einer Abnahme des Längswiderstandes auf ein Viertel. Da jedoch, durch die dabei zunehmende Oberfläche des Axons, gleichzeitig die Membrankapazität zunimmt und der Membranwiderstand sinkt, fällt die Wirkung auf die Leitungsgeschwindigkeit in der Praxis geringer aus.
Elektrotonische Erregungsleitung
Die elektrotonische Erregungsleitung geschieht nur über kurze Entfernungen. Da die Membran um das Axon herum ein relativ schlechter Isolator ist, nimmt das elektrische Potential mit zunehmendem Abstand ab. Ein Beispiel für eine elektrotonische Erregung findet sich in der menschlichen Netzhaut. Hier wird die Erregung als graduierte, reizanaloge Depolarisation elektrotonisch von den Photorezeptoren zu den Ganglienzellen (über die Fortsätze der Horizontal-, Bipolar- und Amakrinen Zellen) übertragen. Diese Form der Erregungsleitung reicht aufgrund des Verhältnisses zwischen Ionenleitung im Inneren (elektrischer Widerstand des Cytoplasmas) und Isolation nach außen (gewisse Leitfähigkeit der das Cytoplasma umgebenden Zellmembran) im besten Falle einige Hundertstel Millimeter weit. Das Potential muss dann wieder durch Aktionspotentiale (Spikes) auf ein Niveau angehoben werden, welches eine weitere Fortleitung beziehungsweise Verarbeitung der Information erlaubt.
Erregungsleitung durch Aktionspotentiale
In Axonen von Nervenzellen bewirkt eine Depolarisation die vorübergehende Öffnung spannungsaktivierter Natriumkanäle. Die resultierende Depolarisationswelle läuft als Aktionspotential über die Nervenfaser. Je nachdem, ob das Axon myelinisiert ist oder nicht, unterscheidet man zwei verschiedene Weisen:
Kontinuierliche Erregungsleitung
Bei marklosen Nervenfasern, das heißt bei fehlender Myelinisierung, wird der Impuls durch das Axon von Abschnitt zu Abschnitt übertragen, indem der vorhergehende Abschnitt ein Aktionspotential an den benachbarten, noch nicht erregten Abschnitt weiterleitet. Der vorhergehende Abschnitt ist bereits in der Repolarisationsphase, während der neu erregte Abschnitt schon seine Permeabilität ändert, um selbst ein Aktionspotential zu erreichen. Diese Form der Weiterleitung ist relativ langsam (meist nur 1–3 m/s, maximal 30 m/s) und findet sich bei Nerven, welche die inneren Organe versorgen, recht häufig. Bekannt sind auch die recht geringen Leitungsgeschwindigkeiten bei Nozizeptoren, die Durchmesser von unter einem Mikrometer haben. Die Leitungsgeschwindigkeit kann durch eine Verdickung des Axons vergrößert werden. Besonders bekannt sind in diesem Zusammenhang die gut untersuchten so genannten Riesenaxone bei Tintenfischen und Meeresschnecken der Gattung Aplysia mit Durchmessern bis zu einem Millimeter. Die Erhöhung des Durchmessers ist allerdings nicht sehr effektiv, da die Verringerung des Leitungswiderstandes teilweise durch eine Vergrößerung der Membrankapazität und einer Verringerung des Membranwiderstandes wieder aufgehoben wird. Eine Verdopplung des Durchmessers führt nur theoretisch zu einer Verdopplung der Leitungsgeschwindigkeit, liegt praktisch aber noch darunter.
Saltatorische Erregungsleitung
Bei Wirbeltieren (Vertebraten) sind die meisten Axone von einer Myelinscheide umhüllt (markhaltige Nervenfaser), die von Schwannschen Zellen im peripheren Nervensystem oder von Oligodendrozyten im Zentralnervensystem gebildet wird und die im Abstand von 0,2 mm bis 1,5 mm unterbrochen ist. Man nennt eine solche Unterbrechung Nodus, Knoten oder Ranvierscher Schnürring. Den myelinisierten, d. h. isolierten Abschnitt, nennt man Internodium.[2] Durch diese Isolation vergrößert sich die Membranlängskonstante (siehe oben) des Axons von wenigen Hundertstelmillimeter auf einige Millimeter. Da die Isolation auch zu einer Verringerung der elektrischen Kapazität von rund 300 nF/m auf etwa 0,8 nF/m führt, verringert sich die Membranzeitkonstante ebenfalls.[3] Allein durch diesen Effekt sind reale Fortleitungsgeschwindigkeiten von über 100 m/s bei unverändertem Querschnitt des Axons möglich. Zudem befinden sich spannungsabhängige Na+-Kanäle sowie Na+/K+-ATPasen in 100-fach höherer Dichte an den Schnürringen. All diese Komponenten ermöglichen, dass ein Aktionspotential, das an einem bis zu 1,5 mm entfernten Schnürring generiert wurde, die Membran am nächsten Schnürring genügend depolarisiert, um dort ein weiteres Aktionspotential auszulösen. Die genauen elektrophysiologischen Vorgänge, die dabei stattfinden sind im Folgenden beispielhaft beschrieben.
An der unerregten Nervenfaser herrscht an jeder Stelle entlang des Axons das Ruhemembranpotential, welches in Abbildung 5 bei -90 mV liegt. Das bedeutet, dass zwischen Intra- und Extrazellulärraum eine Potentialdifferenz besteht, entlang des Axons, also z. B. zwischen N1 und N2 ist dies jedoch nicht der Fall. Kommt nun am ersten Schnürring N1 eine Erregung in Form eines Aktionspotentials an, welches die Membran über das Schwellenpotential, das in Abbildung 5 bei -60 mV liegt, depolarisiert, kommt es zur Öffnung von spannungsabhängigen Na+-Kanälen. Ihrem elektrochemischen Gradienten folgend fließen nun Na+-Ionen vom Extra- in den Intrazellulärraum des Axons. Dadurch kommt es zur Depolarisation der Plasmamembran im Bereich des Schnürrings N1, das heißt der durch die Membran gebildete Kondensator (siehe Grundlagen) wird in Abbildung 5 auf +30 mV umgeladen. Für diesen Vorgang wird eine Zeit von etwa 0,1 ms benötigt[4], die abhängig ist von der bereits im Abschnitt zu den Grundlagen erklärten Membranzeitkonstante. Durch den Einstrom der positiv geladenen Natriumionen ist an N1 intrazellulär ein Überschuss an positiven Ladungsträgern im Vergleich zur Umgebung entstanden. Dies hat augenblicklich die Ausbildung eines elektrischen Feldes und damit einer Potentialdifferenz entlang des Axons zur Folge: das entstandene elektrische Feld übt unmittelbar eine Kraft auch auf weiter entfernte geladene Teilchen aus: an N2 erfahren negativ geladene Teilchen (z. B. Cl--Ionen) eine anziehende Kraft in Richtung des positiven Ladungsüberschusses an N1. Gleichzeitig werden positive Ladungsträger, die sich zwischen N1 und N2 befinden durch das elektrische Feld in Richtung N2 bewegt. Durch diese Ladungsverschiebungen kommt es fast ohne Verzögerung zu einer Positivierung des Membranpotentials an N2, und zwar ohne dass dafür Ionen den ganzen Weg von N1 zu N2 zurückgelegt haben. Dieser Vorgang ist vergleichbar mit dem Einschalten einer Glühbirne durch Betätigung eines entfernten Lichtschalters: Die Glühbirne wird ohne Verzögerung beginnen zu leuchten, weil die Elektronen sofort überall im Kabel in Bewegung versetzt werden und daher auch in der Glühbirne schon ein Strom fließt, obwohl sich jedes einzelne Elektron erst wenige Zentimeter fortbewegt hat.
Wie in Abbildung 5 unten dargestellt, erfolgt die elektrotonische Ausbreitung der Depolarisation über das Internodium somit fast ohne Zeitverlust, während für die Regeneration des Aktionspotentials an den Schnürringen relativ viel Zeit aufgebracht werden muss. Da die Erregung also von Schnürring zu Schnürring zu springen scheint, spricht man von einer saltatorischen Erregungsleitung.[5]
Das Membranpotential entlang des Axons verläuft nun so wie durch die blaue Kurve in Abbildung 5 dargestellt und würde sich mit zunehmendem Abstand von N1 immer weiter dem Ruhemembranpotential annähern (gestrichelter Kurvenverlauf), wenn es nicht durch die überschwellige Depolarisation der Membran an N2 zur Öffnung der dortigen spannungsabhängigen Na+-Kanäle kommen würde. Dadurch kommt es zu einer Regeneration des Aktionspotentials und einem Verlauf des Membranpotentials entsprechend der lila Kurve, bis sich an N3 die geschilderten Vorgänge erneut wiederholen.
Bei einer Leitungsgeschwindigkeit von 120 m/s hat ein Nervenimpuls von 1 ms Dauer eine Länge von 120 mm. Das heißt, beim Durchlauf eines Impulses sind rund 80 bis mehrere hundert Schnürringe gleichzeitig in Erregung. An der Vorderfront des sich ausbreitenden elektrischen Impulses gibt es einen ständigen Wechsel zwischen der elektrotonischen Leitung in den Internodien und der Regeneration der Amplitude des Aktionspotentials in den Schnürringen.
Bei der Geburt fehlen die Markscheiden beim Menschen an einigen Stellen. So sind z. B. die Pyramidenbahnen noch nicht vollständig myelinisert, was dazu führt, dass bei Kleinkindern Reflexe ausgelöst werden können, die bei Erwachsenen als pathologisch (krankhaft) gelten (siehe Babinski-Reflex). Nach zwei Jahren sollten jedoch keine pathologischen Reflexe mehr zu beobachten sein. Bei demyelinisierenden Erkrankungen wie zum Beispiel Multipler Sklerose werden im Zentralnervensystem die Myelinscheiden abgebaut, was zu vielfältigen Ausfallerscheinungen führt.
Erregungsleitung im Neuron
An einer Nervenzelle können bis zu 20 000 Synapsen an den Dendriten und am Zellkörper andocken. Jede einzelne Erregung wird spezifisch zum Axon geleitet. Bei einer der vielen Synapsen reicht eine einzelne Erregung, um ein Aktionspotential am Axonende auszulösen, andere Eingangserregungen hemmen, wieder andere benötigen viele Eingangsimpulse wiederholt oder parallel zur Überschreitung des Schwellenpotentials. Die meisten Eingangserregungen werden über die Zellmembran zum Axon geleitet, seltener durchs Soma. Der Verlauf einer Erregung ist durch Kompartimente abgrenzbar. Nach jeder Erregung verändert sich das Verhalten des Neurons. Wiederholte Aktionspotentiale ermüden das Neuron. Nach jeder Aktion werden die speziellen Wege korrigiert (verfestigt, umgebaut, gelöst). Die Impulse hierzu erhält das Neuron über anliegende Astrozyten. Jede Nervenzelle ist ganz speziell optimiert.
Erreicht ein Aktionspotential oder eine graduierte Depolarisation die Synapse, löst dies eine Folge von Reaktionen aus, die dazu führt dass kleine Bläschen, die so genannten synaptischen Vesikel, mit der präsynaptischen Membran verschmelzen (Exozytose), sich öffnen und dadurch Neurotransmitter in den synaptischen Spalt ausschütten. Diese Transmitter öffnen entweder direkt (ionotrop) oder indirekt (metabotrop) ligandengesteuerte Ionenkanäle in der postsynaptischen Membran. Die Ionenspezifität dieser Kanäle entscheidet, ob die postsynaptische (Nerven-, Muskel-, Rezeptor- oder Drüsen-)Zelle depolarisiert (erregt) oder hyperpolarisiert (gehemmt) wird.
Am Beispiel der neuromuskulären Synapse (Verbindungsstelle zwischen Nervenzelle und Muskel) wird dazu aus den Vesikeln der Transmitter Acetylcholin ausgeschüttet, der den synaptischen Spalt passiert. Die Transmittermoleküle werden an Rezeptormoleküle der postsynaptischen Membran (also der Membran der Folgezelle) gebunden. Je nach Art des Transmitters wird ein erregendes oder ein hemmendes postsynaptisches Potential an die Folgezelle weitergeleitet.
Im Anschluss spaltet (in diesem Fall) die Acetylcholinesterase den Acetylcholin-Transmitter in Acetat und Cholin. Das Cholin wird durch einen Cholinkanal in der Synapse wieder aufgenommen, mit Essigsäure verbunden und wieder als Acetylcholin in einem Vesikel gebunden.
Erregungsverteilung im Nervengewebe
Die Verteilung einer Erregung auf mehrere Neurone wird Divergenz genannt (die Erregung zweigt sich auf). Erhält dagegen ein Neuron Erregung von mehreren Neuronen, dann vereinigt sich die Erregung (Konvergenz). Die hemmende Wirkung auf andere Neurone wird mit Inhibition (Neuron) beschrieben. Wegen der Ähnlichkeit zu einer Kette (die Erregung wird von Neuron zu Neuron weitergegeben), wird die Erregung von Neuron zu Neuron auch als Erregungskette bezeichnet.
Im Nervengewebe findet eine ständige Umbildung der Erregungsleitungen statt. Neue Verbindungen beginnen mit dem Wachstumskegel. Das Lösen bestehender Verbindungen wird Jäten genannt. Bahnung verfestigt bestehende Leitungen.
Ein Erregungsmuster besteht aus einer Unmenge einzelner Erregungsleitungen. Bei einer realen Reizsituation werden immer mehrere Rezeptoren erregt und diese generieren jeweils Erregungsleitungen. Am Erregungsmuster, und nicht an der einzelnen Erregungsleitung, ist die Reizsituation ersichtlich. Beispiel: Unterscheiden der Früchte Apfel und Birne.
Ein Aktivitätsmuster besteht ebenfalls aus Unmengen einzelner Erregungsleitungen. Im Unterschied zum Erregungsmuster wird die jeweilige Aktivität nicht zwingend durch Rezeptoren verursacht. Am Aktivitätsmuster, und nicht an der Aktivität einzelner Hirnareale, ist das jeweilige Denken ersichtlich. Bei den derzeitigen technischen Möglichkeiten (Hirnscan) ist es nur grob möglich, am Aktivitätsmuster die Gedanken zu erkennen.
Erregungsausbreitung im Herzen
Die Erregungsausbreitung im Herzen stellt durch die Kombination von Erregungsleitungssystem und Erregungsübergabe von Zelle zu Zelle eine Einzigartigkeit im Körper dar.
Siehe auch
Weblinks
 Wiktionary: Erregungsleitung – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Wiktionary: Erregungsleitung – Bedeutungserklärungen, Wortherkunft, Synonyme, ÜbersetzungenLiteratur
- Schmidt, Robert F.; Schaible, Hans-Georg: Neuro- und Sinnesphysiologie, 5. Auflage, Springer, 2006, ISBN 3-540-25700-4
Einzelnachweise
- ↑ Wilfried Rall: Time Constants and Electrotonic Length of Membrane Cylinders and Neurons. In: Biophysical Journal. Dezember 1969. PMID 5352228.
- ↑ Benninghoff, Drenkhahn(Hrsg.). Anatomie. Bd 1, 17. Aufl. Urban Fischer. Jena, München 2008. S.187 ff.
- ↑ Herman, Irving P.: Physics of the Human Body. Springer, Berlin 2007. S. 734 ff.
- ↑ Schmidt, Schaible. Neuro- und Sinnesphysiologie. 5. Aufl. Springer Verlag. Heidelberg 2006. S.40.
- ↑ Schmidt, Lang, Thews. Physiologie des Menschen. 29. Aufl. Springer Verlag. Heidelberg 2005. S.80 ff.
Kategorien:- Neurobiologie
- Neurophysiologie
- Biologischer Prozess
Wikimedia Foundation.