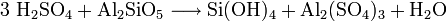- Alumen
-
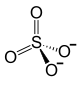
Alaun (englisch: Alum, französisch: Alun, lateinisch: Alumen) wurde früher nur das kristallisierte wasserhaltige schwefelsaure Doppelsalz von Kalium und Aluminium (Kaliumaluminiumsulfat) genannt. Neuerdings bezeichnet man so bisweilen auch das entsprechende Ammoniumaluminiumsalz, während der Name "Alaune" für alle schwefelsauren Doppelverbindungen gleichartiger chemischer Konstitution gilt, wobei dann das für Kalium bzw. Aluminium eintretende Metall der Bezeichnung vorgesetzt wird, zum Beispiel Chromalaun für das schwefelsaure Doppelsalz von Kalium und Chrom. Alaune haben immer die Zusammensetzung MIMIII(SO4)2·12 H2O, wobei MI einwertige Metallkationen wie die Alkalimetalle Natrium, Kalium, Rubidium und Caesium, – mit Ausnahme von Lithium, da es nicht ohne Stabilitätsverlust eingebaut werden kann – Thallium oder auch Ammonium und seine organisch substituierten Derivate sein können; MIII können folgende dreifach positiv geladenen Metallkationen sein: Aluminium, Gallium, Indium, Titan, Vanadium, Chrom, Mangan, Eisen, Cobalt, Rhodium, Iridium und zum Teil auch Thallium[1]. Die typischen Alaune sind die mit Aluminium, Chrom und Eisen. Sämtliche Alaune kristallisieren im kubischen System, meist in der Oktaederform und immer mit 12 Molekülen Kristallwasser. Vom Natrium sind ferner nur zwei sehr unbeständige Alaune bekannt, der Aluminium- und der Chrom- Alaun.
Inhaltsverzeichnis
Geschichte
Die Ägypter nutzten Alaun bereits als Flammschutzmittel für Holz. Gefundene Stücke stammen aus dem Jahr 450 vor Christus. Auch die Römer nutzten es zu diesem Zweck und versetzten es zusätzlich mit Essig. Des Weiteren benutzten sie es als Deodorant: "er entfernt den Gestank unter den Achseln sowie auch den Schweiß" (Plinius, Naturkunde 35,52)
Während der Zeit des 14. und 15. Jahrhunderts besaß die Florentiner Familie der Medici das alleinige Vergütungsrecht auf dieses zur Tuchherstellung nötige Mineral. Sie betrieben zusammen mit der Kirche das erste europäische Alaunwerk in Tolfa.
1578 verkaufte der zum Protestantismus übergetretene Bankier Horatio Palavicino, dessen Familie das päpstliche Alaunmonopol verwaltete, den gesamten Vorrat an die Niederländer gegen einen von Königin Elisabeth von England unterzeichneten Schuldschein über 29.000 Pfund und die Gewährung des Importmonopols.
In den 1830er-Jahren betrieben Leopold Bleibtreu (1777–1839) und sein Bruder Abraham (1775–1852) die größte Alaunhüttenunternehmung Preußens im Bonner Stadtteil Holzlar.
Gewinnung
 In dieser römischen Amphore, gefunden in Bliesbruck, wurde Alaun von den Liparischen Inseln zum Färben von Wolle transportiert. Pompeii-Ausstellung 2007, Europäischer Kulturpark Bliesbruck-Reinheim
In dieser römischen Amphore, gefunden in Bliesbruck, wurde Alaun von den Liparischen Inseln zum Färben von Wolle transportiert. Pompeii-Ausstellung 2007, Europäischer Kulturpark Bliesbruck-ReinheimZur Gewinnung des gewöhnlichen Kalialauns wird schwach gebrannter, möglichst eisenfreier Ton mit 50 %iger Schwefelsäure in der Wärme behandelt. Dabei bildet sich unter Abscheidung von Kieselsäure ein Bestandteil des Alauns: Aluminiumsulfat, früher auch schwefelsaure Tonerde genannt.
Nach dem Verdünnen mit Wasser und Entfernen des unlöslichen Rückstandes, der Kieselsäure, wird Kaliumsulfat oder auch Chlorkalium hinzugesetzt, und das sich dabei als feines Pulver abscheidende »Alaunmehl« durch Umkristallisieren aus heißem Wasser gereinigt und in große Kristalle verwandelt. In gleicher Weise kann man Bauxit oder Kryolith verarbeiten.
Gewinnung in so genannten Alaunwerken (historisch Ende des 18. Jahrhunderts bis Ende 19. Jahrhunderts): In einigen Gegenden (beispielsweise bei Schwemsal nahe Bad Düben, Sachsen-Anhalt[2]) fabrizierte man Alaun auch aus Alaunschiefer, der geröstet und dann ausgelaugt wurde. Hierbei lieferte das Schwefeleisen die zur Bildung von Aluminiumsulfat nötige Schwefelsäure und die Tonminerale das Aluminium. Kalium wurde meist als Pottasche (K2CO3) der Lauge zugesetzt. Die Entfernung des Eisens wurde durch geeignete Wahl der Konzentration der Lösung bewirkt. Dann wurde wie bei obigem Verfahren das »Alaunmehl« erzeugt.
Bei Tolfa in Italien und bei Munkács in der (früher ungarischen) westlichen Ukraine kommt ein »Alaunstein« oder »Alunit« genanntes Mineral vor, welches ein basisches Kaliumaluminiumsulfat ist. Dieses Material wurde geröstet und mit heißem Wasser ausgelaugt, wobei unlösliche Tonerde zurückblieb, während sämtliche Bestandteile des Alauns in Lösung gingen und sich beim Erkalten in gewöhnlich durch fein verteiltes Eisenoxyd schwach rötlich gefärbten Kristallen abschieden.
Verwendung
Der Alaun findet vielfache Verwendung, wobei fast stets nur das Aluminiumsulfat in Wirksamkeit tritt. In der Papierfabrikation dient er zum Leimen, in der Gerberei zum Weißgarmachen der Häute, in der Kattundruckerei und in der Zeugfärberei zum Beizen (siehe auch Färberpflanzen). Ferner wird er benutzt zum Wasserdichtmachen von Zeugstoffen, die nachher durch Ölsäure gezogen werden, zum Klären von Flüssigkeiten usf. In vielen Fällen muss der Alaun vollkommen frei von Eisen sein, dessen Gegenwart mittels Blutlaugensalz (Blaufärbung) nachgewiesen wird. In der Färberei und Weißgerberei benutzt man jetzt vielfach statt des Alaun Aluminiumsulfat selbst, welches daher auch oft als »konzentrierter Alaun« bezeichnet wird.
- Ammoniumalaun (Alumen amoniacale), (NH4)Al(SO4)2·12 H2O, wird entsprechend dem Kalialaun hergestellt, indem man Aluminiumsulfat statt mit Kaliumsulfat mit Ammoniumsulfat versetzt. Er enthält 49,62 % Kristallwasser, ist leichter in kaltem Wasser löslich als der gewöhnliche Alaun und wird wie dieser verwendet. Der Gehalt an wasserfreiem Aluminiumsulfat beträgt beim Kalialaun 10,8 %, beim Ammoniumalaun 11,9 % und beim sog. konzentrierten Alaun (s. o.) 15,4 %. Ammoniakalaun, welcher übrigens häufig ein Gemisch mit Kalialaun ist, gibt beim Behandeln mit Ätzkali den stechenden Geruch nach Ammoniak (Salmiakgeist).
- Natronalaun wird nur selten benutzt, da er schnell verwittert, trübe wird und schließlich zu einem weißen Pulver zerfällt.
- Der Chromalaun, KCr(SO4)2·12 H2O (Alumen chromicum), in welchem das Aluminium durch Chrom ersetzt ist, wird vielfach als Abfallprodukt der Teerfarbenfabriken, welche die Chromsäure als Oxidationsmittel benutzen, erhalten und in der Färberei und Gerberei verwandt. Er besteht aus bei auffallendem Lichte fast schwarzen, bei durchfallendem Lichte dunkelroten Oktaedern, die sich in Wasser mit violetter Farbe lösen.
Alaun wird auch dazu verwendet, Knetmasse herzustellen. Häufigste Anwendung im täglichen Leben ist der Alaunstift, der zur Blutstillung eingesetzt wird. Aber auch im Gartenwesen wird Alaun eingesetzt. Hier werden Hortensien mit Alaun „gedüngt“, um eine violette bzw. blaue Färbung der Blüten hervorzurufen. In Thailand etwa wird er dem Wasser beigegeben, um die Schwebstoffe darin zu binden und das erdige Wasser so zu klären. Auch als Deodorant (Pierre d'Alun) wird er verwendet. Der Alaun wird genässt und auf die zu deodorierenden Stellen aufgetragen, wodurch die adstringente Wirkung des Alauns die Schweißporen des Körpers an den betreffenden Stellen schließt. In China wird seit Jahrhunderten Alaunpulver 明矾粉 míngfánfěn zur Herstellung des frittierten Frühstücksgebäcks Youtiao 油条 yóutiáo benutzt.
- Beliebt sind der Kalium-Aluminium und der Kalium-Chrom-Alaun bei den Kristallzüchtern. Beide Alaune lassen sich sehr schön zu zentimetergroßen Kristallen züchten.
Kalialaun
Der Kalialaun, KAl(SO4)2·12 H2O, enthält 45,5 % Kristallwasser, bildet farblose, durchsichtige, bisweilen sehr große Kristalle, die sich erst bei längerem Lagern an der Luft mit einem feinen, weißen, undurchsichtigen Häutchen von verwitterter Substanz überziehen, schmeckt herbe und zugleich süßlich und kann in größeren Dosen schädlich wirken. Das spezifische Gewicht wird von Kopp zu 1,924 angegeben. Beim Erwärmen schmilzt der Alaun zunächst in seinem Kristallwasser und hinterlässt schließlich eine lockere, weiße, undurchsichtige Masse, die man gebrannten Alaun (Alumen ustum) nennt. Seine Löslichkeit ist in heißem Wasser sehr groß, in kaltem sehr gering, so dass die Reindarstellung verhältnismäßig leicht gelingt; die Lösung reagiert sauer. Als häufigste Kristallform zeigt sich das Oktaeder, an welchem zuweilen die Würfelflächen abstumpfend auftreten. Besonders ist dies bei dem früher seiner Reinheit wegen hochgeschätzten römischen Alaun der Fall, welcher deshalb auch kubischer oder Würfelalaun genannt wurde. Die Würfelform lässt sich dadurch erzielen, dass man zu der heißen konzentrierten Lösung Pottasche (Kaliumcarbonat), Soda (Natriumcarbonat) oder Ammoniak hinzusetzt, bis ein bleibender Niederschlag entsteht, und dann erst erkalten lässt. Solche Kristalle heißen neutraler oder abgestumpfter Alaun und sind, chemisch betrachtet, basische Salze.
Chromalaun
Formel: KCr(SO4)2·12H2O (vollständige Bezeichnung Chrom(III)-Kaliumsulfat-Dodecahydrat oder Kaliumchrom(III)-sulfat). Chromalaun ist dunkelviolett und kristallisiert in Oktaedern. Gemischt mit Kalialaun eignet es sich gut für die einfache Kristallzucht.
Alaune mit Selenaten
Es gibt auch einige wenige Selenate SeO42-, die in ihrer Kristallstruktur den Alaunen entsprechen. Bisher sind solche Verbindungen ausschließlich mit dem großen Caesiumion als Alkalikomponente bekannt. Die allgemeinen Formel lautet CsMIII(SeO4)2·12H2O (MIII = Al, Fe, In, Cr, Rh).[3]
Liste der möglichen Alaun-Kombinationen
Aluminium
- NaAl(SO4)2·12 H2O
- KAl(SO4)2·12 H2O
- RbAl(SO4)2·12 H2O
- CsAl(SO4)2·12 H2O
- TlAl(SO4)2·12 H2O
- NH4Al(SO4)2·12 H2O
Gallium
- KGa(SO4)2·12 H2O
- RbGa(SO4)2·12 H2O
- CsGa(SO4)2·12 H2O
- TlGa(SO4)2·12 H2O
- NH4Ga(SO4)2·12 H2O
Indium
- RbIn(SO4)2·12 H2O
- CsIn(SO4)2·12 H2O
- NH4In(SO4)2·12 H2O
Titan
- KTi(SO4)2·12 H2O
- RbTi(SO4)2·12 H2O
- CsTi(SO4)2·12 H2O
- NH4Ti(SO4)2·12 H2O
Vanadium
- KV(SO4)2·12 H2O
- RbV(SO4)2·12 H2O
- CsV(SO4)2·12 H2O
- NH4V(SO4)2·12 H2O
Chrom
- NaCr(SO4)2·12 H2O
- KCr(SO4)2·12 H2O
- RbCr(SO4)2·12 H2O
- CsCr(SO4)2·12 H2O
- TlCr(SO4)2·12 H2O
- NH4Cr(SO4)2·12 H2O
Mangan
- RbMn(SO4)2·12 H2O
- CsMn(SO4)2·12 H2O
Eisen
- KFe(SO4)2·12 H2O
- RbFe(SO4)2·12 H2O
- CsFe(SO4)2·12 H2O
- TlFe(SO4)2·12 H2O
- NH4Fe(SO4)2·12 H2O
Cobalt
- KCo(SO4)2·12 H2O
- RbCo(SO4)2·12 H2O
- CsCo(SO4)2·12 H2O
- NH4Co(SO4)2·12 H2O
Rhodium
- RbRh(SO4)2·12 H2O
- CsRh(SO4)2·12 H2O
Iridium
- RbIr(SO4)2·12 H2O
- CsIr(SO4)2·12 H2O
Quellen
- Adolf Beythien, Ernst Dressler (Hrsg.): Mercks Warenlexikon. 7. Auflage. Gloeckner, Leipzig 1920 (unveränderter Nachdruck: Manuscriptum, Recklinghausen 1996) [1]
Einzelnachweise
- ↑ Dr. Heinrich Remy: Lehrbuch der Anorganischen Chemie Band I + II, Leipzig 1973
- ↑ Jutta Schütz: Die Alaunherstellung in Schwemsal / Düben. Faltblatt Nr. 6 der Reihe Notizen zur Geschichte der Stadt. Heimatverein Bad Düben e. V., 2007
- ↑ R. S. Armstrong, K. B. Beattie, S. P. Best, G. P. Braithwaite, R. del Favero, B. W. Skelton, A. H. White, Australian Journal of Chemistry, 1990, 43, 393-398
Weblinks
Wikimedia Foundation.