- Immunoglobin
-
Antikörper (Immunglobuline, im internationalen Sprachgebrauch auch Immunoglobulin) sind Proteine (Eiweiße) aus der Klasse der Globuline, die in Wirbeltieren als Reaktion auf bestimmte Stoffe, s.g. Antigene, gebildet werden. Antikörper stehen im Dienste des Immunsystems.
Als Antigene wirken fast ausschließlich Makromoleküle oder an Partikel gebundene Moleküle, zum Beispiel Lipopolysaccharide an der Oberfläche von Bakterien. Ein bestimmtes Antigen induziert in der Regel die Bildung nur weniger, ganz bestimmter, dazu passender Antikörper, die über spezifische, non-kovalente Bindung zumeist nur diesen Fremdstoff erkennen (dass auch verwandte Targets erkannt werden können, macht man sich z. B. bei der Pockenschutzimpfung zunutze: Die vom Körper gegen die harmlosen Kuhpocken gebildeten Antikörper erkennen auch für Menschen pathogene Pockenviren).
Die spezifische Bindung von Antikörpern an die Antigene bildet einen wesentlichen Teil der Abwehr gegen die eingedrungenen Fremdstoffe. Bei Krankheitserregern (Pathogenen) als Fremdstoffe kann die Bildung und Bindung von Antikörpern zur Immunität führen. Antikörper sind also zentrale Bestandteile des Immunsystems höherer Wirbeltiere. Man bezeichnet Antikörper auch als Immunglobuline (Ig).Antikörper werden von einer Klasse von weißen Blutzellen (Leukozyten), d. h. zu Effektorzellen differenzierten B-Zellen (=Plasmazellen), sezerniert (abgesondert). Sie kommen im Blut und in der extrazellulären Flüssigkeit der Gewebe vor. Sie „erkennen“ meist nicht die gesamte Struktur des Antigens, sondern nur einen Teil desselben, die sogenannte antigene Determinante (das Epitop). Die spezifische Antigenbindungsstelle des Antikörpers bezeichnet man als Paratop. Die Antikörper erzeugen beim Kontakt mit dem Antigen die sog. humorale Immunantwort.
Struktur von Antikörpern
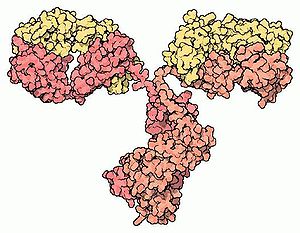
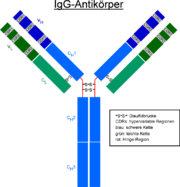
Jeder Antikörper besteht aus zwei identischen schweren Ketten (heavy chains, H) und zwei identischen leichten Ketten (light chains, L), die durch kovalente Disulfidbrücken zu einer Ypsilon-förmigen Struktur miteinander verknüpft sind. Die leichten Ketten bestehen aus jeweils einer variablen und einer konstanten Domäne. Bezeichnet werden diese als VL und CL. Die schweren Ketten hingegen haben jeweils eine variable und 3 (IgG, IgA) bzw. 4 (IgM, IgE) konstante Domänen. Bezeichnet werden diese analog als VH und CH1, CH2, CH3.
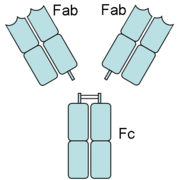
Die variablen Domänen einer leichten und einer schweren Kette bilden die Antigenbindungsstelle. Die Domäne CH2 besteht u. a. auch aus einer Kohlenhydratkette, die eine Bindungsstelle für das Komplementsystem bildet. Die Domäne CH3 ist die Fc-Rezeptor-Bindungsstelle zur Opsonierung.Die beiden Leichtketten sind je nach Organismus und Immunglobulin-Subklasse entweder vom Typ κ oder λ und bilden zusammen mit den oberhalb der Gelenkregion (hinge region) liegenden Anteil der schweren Ketten das Antigenbindende Fragment Fab, welches enzymatisch mit Hilfe von Papain von dem darunterliegenden kristallinen Fragment Fc abgespalten werden kann. Die ausgesprochene Variabilität der Antikörperbindungsstellen (abgekürzt CDR, Complementarity Determining Region) erreicht der Organismus über die V(D)J-Rekombination.
Papain spaltet oberhalb der Disulfidbrücken beider schwerer Ketten zueinander. Man erhält 2 Fab-Fragmente und ein vollständiges Fragment Fc. Pepsin hingegen spaltet unterhalb der Disulfidbrücken. D.h. die Gelenkregion (hinge region) bleibt zwischen beiden Fab-Fragmenten erhalten. Man nennt dieses Fragment dann F(ab')2. Pepsin und Plasmin spalten auch das Fc-Fragment zwischen der zweiten und dritten Domäne des konstanten Teils der schweren Kette.
Antigen – Antikörper – Bindung
Antikörper binden mit ihrer A(ntigen)B(indungs)-Region „ihr“ Epitop relativ spezifisch, analog dem Schlüssel-Schloss-Prinzip. Es passiert jedoch nicht selten, dass, metaphorisch gesprochen, ein zweiter oder dritter Schlüssel existiert, der in das Antikörper-„Schloss“ passt, aufgrund der (zufällig) ähnlichen oder identischen Konfiguration des Epitops. Mit sehr geringer Wahrscheinlichkeit kann das auch eine körpereigene Struktur sein. Auf diesem Phänomen beruht ein Ansatz zur Erklärung von Autoimmunerkrankungen.
Die Bindung zwischen Epitop und Immunglobulin ist nicht-kovalent und unterliegt dem Massenwirkungsgesetz. Eine effektive Agglutination, das heißt eine Ausbildung großer Komplexe, ist daher nur bei etwa gleicher Anzahl von Epitopen und Bindungsstellen möglich. Bei großen Abweichungen nach oben oder unten ist weniger die Komplexierung, sondern die Neutralisation der entscheidende Prozess.[1]
Antikörper als B-Zell-Rezeptoren
Membranständige Antikörper (als B-Zell-Rezeptoren (BCR) bezeichnet) können B-Zellen aktivieren, wenn sie durch Antigene quervernetzt werden. Die B-Zelle nimmt daraufhin den Immunkomplex durch Endozytose auf, verdaut das Antigen proteolytisch und präsentiert über MHC Klasse II Moleküle Fragmente davon (Peptide mit 8–12 Aminosäuren) auf ihrer Zelloberfläche. Wenn die präsentierten Fragmente auch (parallel auf anderen professionellen antigenpräsentierenden Zelle APC oder auf eben dieser B-Zelle) von einer CD4-T-Zelle (T-Helferzellen) erkannt werden, stimuliert diese T-Zelle die B-Zelle, was weitere Reifungsprozesse (somatische Hypermutation, Klassenwechsel) und Proliferation zu antikörpersezernierenden Plasmazellen oder/und zu Gedächtnis-B-Zellen auslöst. Diese Reifungsprozesse finden innerhalb von Keimzentren (germinal center) in den sekundären lymphatischen Organen (Milz, Lymphknoten) statt und werden unter dem Begriff der Keimzentrumsreaktion (germinal center reaction) zusammengefasst. Der B-Zell-Rezeptor ist, mit Ausnahme eines kleinen Teils am Carboxylende der schweren Kette, mit dem Antikörper der jeweiligen B-Zelle identisch. Der B-Zell-Rezeptor besitzt dort eine hydrophobe, in der Zell-Membran verankerte Sequenz, der Antikörper dagegen eine hydrophile Sequenz, die seine Sekretion bewirkt.
Wirkungsweisen von sezernierten Antikörpern
Sezernierte Antikörper wirken durch verschiedene Mechanismen:
- Die einfachste ist die Neutralisation von Antigenen. Dadurch, dass der Antikörper das Antigen bindet, wird dieses blockiert und kann beispielsweise seine toxische Wirkung nicht mehr entfalten, oder andere Wechselwirkungen des Antigens mit Körperzellen (z. B. das Eindringen von Bakterien oder Viren in Zellen oder Gewebe) werden verhindert.
- Ein weiterer ist die Opsonisierung („lecker machen“), das Einhüllen von Krankheitserregern und Fremdpartikeln mit Antikörpern. Wenn ein Antikörper beispielsweise an ein Antigen bindet, das sich auf der Oberfläche eines Bakteriums befindet, markiert er damit gleichzeitig das Bakterium, denn die konstante Region des Antikörpers, der an sein Antigen gebunden hat, wird von Phagozyten erkannt, die als Fresszellen das Bakterium aufnehmen und verdauen können.
- Eine dritte Wirkungsweise ist, dass Antikörper das Komplementsystem aktivieren.
- Antikörper, die an körpereigene Zellen binden, können NK-Zellen aktivieren, welche diese Zellen dann abtöten. Dieser Prozess wird auch als „Antibody-dependent cell-mediated cytotoxicity“ (ADCC) bezeichnet.
- Dadurch, dass ein Antikörper zwei Antigenbindungsstellen aufweist, kann es zur Agglutination kommen.
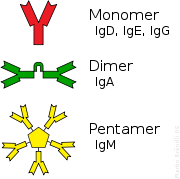
Verschiedene Klassen von Antikörpern
Bei den meisten Wirbeltieren gibt es fünf verschiedene Klassen (Isotypen) von Immunglobulinen, die anhand ihrer unterschiedlichen Gen-Abschnitte für die konstanten Teile der schweren Kette eingeteilt werden. Darüber hinaus gibt es einige Klassen, die nur in einzelnen Tiergruppen zu finden sind. Die verschiedenen Isotypen kommen in verschiedenen Kompartimenten des Körpers vor und haben unterschiedliche Aufgaben.
Immunglobulin A
Immunglobulin A (IgA) wird auf allen Schleimhäuten der Atemwege, der Augen, des Magen-Darm-Trakts, des Urogenitaltrakts sowie über spezielle Drüsen rund um die Brustwarze von Müttern sezerniert und schützt dort vor Pathogenen (auch das Neugeborene). Sezerniertes IgA kommt in Form von Homodimeren vor; die beiden Anteile sind durch das Joining-Peptide verbunden.
Immunglobulin D
Immunglobulin D (IgD) wird durch alternatives Spleißen der IgM/IgD-Prä-mRNA zusammen mit IgM als B-Zell Rezeptor (BCR) auf reifen, naiven (antigenunerfahrenen) B-Zellen membranständig coexprimiert. IgD ist nur in geringen Mengen in sezernierter Form in Blut und Lymphe vorhanden, Funktion unbekannt.
Immunglobulin E
Immunglobulin E (IgE) vermittelt den Schutz vor Parasiten, wie z. B. Würmern. Es wird durch Fc-Rezeptoren auf Mastzellen gebunden. Aus diesem Grund ist nahezu alles IgE membrangebunden, im Blut ist es praktisch nicht vorhanden. Bei Antigenkontakt wird es quervernetzt, was zur Ausschüttung von Histaminen, Granzymen etc. durch die Mastzellen (Mastzelldegranulation – hier greifen Allergiemedikamente, die die Mastzellen „stabilisieren“) und Granulozyten führt (allergische Sofortreaktion). Die ausgeschütteten Mediatoren wirken stark gefäßerweiternd, was das Herankommen anderer Immunzellen erleichtert. Es wirkt außerdem muskelkontrahierend, was die Ausscheidung der Erreger über Lunge und Darm erleichtert.
Immunglobulin M
Immunglobulin M (IgM) ist die erste Klasse von Antikörpern, die bei Erst-Kontakt mit Antigenen gebildet wird und zeigt die akute Infektionsphase einer Krankheit an, beispielsweise anti-Masern-IgM, gegen das Masernvirus gerichtete Antikörper der IgM-Klasse als Zeichen einer frischen Infektion.
IgM ist ein Pentamer (Multimer) aus fünf Untereinheiten. Auch diese Untereinheiten sind durch das Joining Peptide verbunden. Da IgM 10 Bindestellen für Antigene hat, führen diese Antikörper zu einer starken Agglutination. Der Antigen-Antikörperkomplex von IgM-Pentameren aktiviert den klassischen Weg des Komplementsystems, weiterhin werden die Blutgruppen von IgM-Antikörpern erkannt.
Immunglobulin G
Immunglobulin G (IgG) wird erst in einer verzögerten Abwehrphase (3 Wochen) gebildet und bleibt lange erhalten. Der Nachweis zeigt eine durchgemachte Infektion oder eine Impfung an. Ein Beispiel ist anti-Masern-IgG, gegen das Masernvirus gerichtete Antikörper der IgG-Klasse als Zeichen einer gegenwärtigen oder früheren Infektion oder Impfung. Die Rhesusfaktor D Antikörper sind ebenfalls von diesem Typ, was zu Komplikationen bei einer Schwangerschaft führen kann, da Immunglobulin G plazentagängig ist.
Immunglobulin Y
Immunglobulin Y (IgY) auch Chicken IgG, Egg Yolk IgG oder 7S-IgG genannt, ist in Hühnern das funktionelle Äquivalent zu IgG und ähnelt diesem in seiner Struktur. Es ist in hohen Konzentrationen in Hühnereiern zu finden. Für die Verwendung für bioanalytische Zwecke in Immunoassays bietet IgY verschiedene Vorteile gegenüber IgG.
Immunglobulin W
Immunglobulin W (IgW) wurde erst 1996 in einer Haiart entdeckt. Aufgrund dessen wurde ursprünglich angenommen, dass es nur in Knorpelfischen vorkommt. 2003 wurde IgW jedoch auch in Lungenfischen, einer Klasse der Knochenfische, nachgewiesen. IgW besitzt wahrscheinlich einige Eigenschaften eines hypothetischen Ur-Immunglobulins und ist deshalb vor allem für die Forschung zur Evolution des Immunsystems von Interesse.
Krankheiten mit einem angeborenen oder erworbenen Mangel an Antikörpern betreffen oft IgG, siehe Antikörpermangel. Bildet der Körper gegen eigene Körperbestandteile Antikörper, so genannte Autoantikörper, spricht man von einer Autoimmunkrankheit. IgG wird außerdem aktiv über das Blut und die Plazenta(barriere) in den Fötus transportiert und sorgt dort auch nachgeburtlich für einen ersten Schutz vor Infektionen. Über zwei antigengebundene IgG wird das Komplementsystem aktiviert. Der Fc-Rezeptor vermittelt Phagozytose.
Pharmakologie
Immunglobulin G besitzt ein breites Antikörperspektrum gegen verschiedene infektiöse Erreger. Opsonisierung und Neutralisierung von Mikroben und Toxinen durch spezifische Antikörper wurden nachgewiesen. IgG-Antikörper werden aus Plasma von mindestens 1000 Spendern hergestellt; die Subklassenverteilung entspricht der des humanen Plasmas. Durch entsprechende Dosierungen können erniedrigte IgG-Serumspiegel auf Normalwerte angehoben werden. Der Wirkmechanismus bei anderen Anwendungsgebieten als der Substitutionstherapie ist noch nicht vollständig erforscht, schließt jedoch immunmodulatorische Wirkungen ein. Die Fertigprodukte sind auf einen schwach sauren pH-Wert eingestellt. Nach Verabreichung hoher Dosen von IgG wurde keine Veränderung des Blut-pH-Wertes gemessen. Die Osmolalität von Fertigarzneimitteln liegt nahe an den physiologischen Werten (285 – 295 mOsmol/kg).
Pharmakokinetik
Immunglobuline sind nach intravenöser Verabreichung in der Blutbahn des Empfängers unmittelbar und vollständig bioverfügbar. Sie verteilen sich relativ rasch zwischen Plasma und extravaskulärer Flüssigkeit; nach ca. 3 bis 5 Tagen wird ein Gleichgewicht zwischen intra- und extravaskulärem Kompartiment erreicht. Die in-vivo Halbwertszeit von IgG bei Patienten mit primärem Antikörpermangelsyndrom beträgt 35 Tage. Die Halbwertszeit von IgG kann jedoch von Patient zu Patient variieren, vor allem bei Patienten mit primären Immunmangelsyndromen. Immunglobuline und IgG-Komplexe werden in den Zellen des mononukleären phagozytischen Systems abgebaut.
Präklinische Daten zur Sicherheit
Immunglobuline sind normale Bestandteile des menschlichen Körpers. Die akute Toxizität beim Tier ist nicht festzulegen, da das zu verabreichende Volumen oberhalb der tolerierbaren Grenze läge. Tierstudien über chronische Toxizität und Embryotoxizität sind nicht möglich, da diese durch die Bildung von Antikörpern gegen Humanproteine gestört werden. Klinische Erfahrungen haben keine Hinweise auf kanzerogene oder mutagene Effekte geliefert. Deswegen wurden experimentelle Untersuchungen am Tier nicht für notwendig erachtet.
Anwendung von Antikörpern in der Medizin
Aus Tieren gewonnene Antikörper (Antiseren) werden als Therapeutikum für verschiedenste Zwecke eingesetzt. Ein wichtiges Beispiel ist die Verwendung als passiver Impfstoff.
Antikörper werden therapeutisch bei einigen Erkrankungen als Intravenöse Immunglobulingaben (IVIG) verabreicht. Außerdem werden spezifische monoklonale Antikörper seit neuestem in der Medizin therapeutisch eingesetzt. Hauptanwendungsgebiet ist die Hämatologie und Onkologie, daneben werden sie auch in der Behandlung von Autoimmunerkrankungen wie Multipler Sklerose oder Rheumatoider Arthritis (RA) eingesetzt. Hierbei erkennen diese Antikörper pro-inflammatorische Zytokine wie IL-1 oder TNF-a. Antikörper gegen den B-Zell-Oberflächenmarker CD20 erkennen zwar nur naive (antigenunerfahrene) und Gedächtnis-B-Zellen, jedoch keine Plasmazellen (CD20neg), dennoch ist auch diese Therapie relativ erfolgreich. Damit stellen Antikörper eine Medikamentenklasse dar, die erstmals in der Lage ist, spezifisch in die entzündlichen Vorgänge einzugreifen (Biologicals).
Antikörper können auch dazu benutzt werden, bestimmte Stoffe im Körper ausfindig zu machen. Dazu hängt man an den Antikörper einen schwach radioaktiven Stoff. Wenn man den Antikörper nun darauf ausrichtet, sich an einen bestimmten Stoff zu hängen, indem man die Antigen-Bindestelle entsprechend verändert, kann man durch Szintigrafie feststellen, wo der radioaktive Stoff sich genau befindet. Dies kann zum Beispiel dazu benutzt werden, Geschwülste im Körper ausfindig zu machen.
Früher war der konstante Teil der Antikörper noch murin (aus der Maus), was zu Abstoßungsreaktionen durch das Immunsystem führen konnte. Um dieses Problem zu umgehen, werden neuerdings sogenannte humanisierte Antikörper verwendet. Herkömmliche monoklonale Antikörper enthalten neben der die Spezifität gegen humane Antigene vermittelnden variablen Region immer noch Proteinbestandteile der Maus, die das menschliche Immunsystem möglicherweise als fremdartig abstößt. Mit Hilfe molekularbiologischer Verfahren werden deshalb die murinen Teile der konstanten Abschnitte entfernt und durch baugleiche konstante Teile menschlicher Antikörper ersetzt. Die konstanten Abschnitte der Antikörper spielen für die spezifische Bindung des monoklonalen Antikörpers keine Rolle. Der so entstandene monoklonale Antikörper wird als „humanisierter monoklonaler Antikörper“ bezeichnet und wird vom Immunsystem des Menschen nicht mehr abgestoßen. Humanisierte Antikörper werden in einer Kultur aus Hamster-Ovarialzellen hergestellt, weshalb ihre Produktion sehr viel aufwendiger und deshalb auch teurer als die Produktion in Mikroorganismen ist.
Bei der Radioimmuntherapie ist eine ionisierende Strahlungsquelle an einen Antikörper gekoppelt.
Anwendung von Antikörpern in der Biologie
Die hohe Spezifität, mit der Antikörper ihr Antigen erkennen, macht man sich in der Biologie zu Nutze, um das Antigen, in den allermeisten Fällen ein Protein, sichtbar zu machen. Die Antikörper sind entweder direkt mit einem Enzym (setzt ein Substrat in Farbe oder Chemoluminiszenz um), mit Fluoreszenzfarbstoffen oder mit radioaktiven Isotopen gekoppelt (gelabelt) oder werden mit einem Sekundärantikörper, der an den ersten (Primärantikörper) bindet und entsprechend gelabelt ist, nachgewiesen.
- Immunohistochemie: Nachweis eines Antigens auf einer Zelloberfläche, im Zytoplasma oder im Zellkern mittels Antikörpern auf Gewebsdünn- (Cryo- oder Paraffin-) schnitten und damit indirekter Nachweis von Zelltypen, Differenzierungsstadien etc..
- ELISA: Quantifizierung von Antigenen oder Antikörpern im Serum, Zellkulturüberständen etc. mittels enzymgekoppelter Antikörper
- ELISPOT: Nachweis von antikörper- oder antigensezernierenden Zellen (Plasmazellen, zytokinsezernierende Zellen) mittels enzymgekoppelter Antikörper
- FACS: Quantifizierung von Zellen mittels fluoreszenzgekoppelter Antikörper gegen Antigene auf der Zelloberfläche, im Zytoplasma oder im Zellkern
- Western Blot
- Supergelshift (auch EMSA)
- Schwangerschaftstest
- Phagen-Display
- Drugwipe-Test
- Abzyme
Gewinnung von Antikörpern
→ siehe auch: Immunserum
Polyklonale Antiseren
Polyklonale Antiseren sind eine Mischung aus verschiedenen gegen diverse Epitope/Antigene gerichteten Antikörpern. Zunächst muss das Antigen, gegen das der Antikörper gerichtet sein soll, ausgewählt und produziert werden. Dies kann auf verschiedene Weisen erreicht werden, zum Beispiel, indem ein Protein ganz einfach isoliert, ein Peptid in vitro synthetisiert oder das Protein als ganzes rekombinant in Bakterien hergestellt wird. Anschließend wird das Protein einem Tier eingespritzt, dessen Immunsystem dann Antikörper gegen das Protein bildet. Dieser Vorgang heißt „Immunisierung“. Als Antikörper-Produzenten werden besonders Mäuse, Ratten und Kaninchen, aber auch Ziegen, Schafe und Pferde verwendet. Die Immunisierung wird mehrfach wiederholt. Nach ein paar Wochen kann das polyklonale Antiserum entnommen werden. Darin sind verschiedene durch die Immunisierung gebildete, gegen das Antigen gerichtete Antikörper enthalten, die sich im erkannten Epitop unterscheiden können.
Monoklonale Antikörper
Ein monoklonaler Antikörper ist gegen ein Epitop/Antigen gerichtet. Zunächst müssen, wie bei der polyklonalen Antikörperherstellung beschrieben, Tiere immunisiert und dann deren Plasmazellen (aus Milz oder Lymphknoten) gewonnen werden. Da die Plasmazellen die Fähigkeit zur Zellteilung verloren haben, muss zuerst eine Verschmelzung mit Tumorzellen erfolgen. Die so entstandenen Zellhybriden (Hybridoma-Zellen) erhalten von den Plasmazellen die Eigenschaft, einen bestimmten Antikörper zu produzieren und zu sekretieren und von der Tumorzelle die Fähigkeit, in Kultur sich theoretisch unendlich oft teilen zu können und somit theoretisch unendlich lange zu leben. Durch mehrfaches Vereinzeln (Klonieren) wird ein Stamm von Zellen gewonnen, der auf eine einzelne Hybridoma-Zelle und somit auf eine einzelne Plasma-Zelle zurückgeht. Die so erhaltenen Zelllinien können nun in Kultur unendlich stark expandiert werden und damit auch theoretisch unendlich große Mengen Antikörper produzieren. Da alle Zellen auf eine einzige Zelle zurückzuführen sind, handelt es sich bei allen Zellen einer Kultur um identische Kopien ein und derselben Zelle. Aufgrund dessen produzieren auch alle Zellen einen bestimmten, identischen Antikörper, der sich hinsichtlich seiner Eigenschaften (z. B. Bindungstelle am Antigen, Stärke der Bindung etc.) genau definieren lässt und in theoretisch unbegrenzter Menge herstellbar ist.
Rekombinante Antikörper
Rekombinante Antikörper werden in vitro hergestellt, d. h. ohne Versuchstier. Rekombinante Antikörper werden typischerweise aus Genbibliotheken hergestellt, die für die Herstellung der Antikörper in Mikroorganismen geeignet sind. Die Auswahl des richtigen (=spezifisch bindenden Antikörpers) erfolgt dabei nicht durch das Immunsystem eines Tieres/Menschen, sondern durch einen Bindungsschritt im Reagenzglas. Rekombinante Antikörper können auf vielfältige Weise angewendet werden, da sie einfach verändert werden können, denn ihre Erbsubstanz ist bekannt. So kann ihre Bindungsstärke oder Stabilität verbessert werden, oder es können Eiweißstoffe mit anderen Funktionen angehängt werden, z. B. zur Erzeugung von bispezifischen Antikörpern oder Immuntoxinen.
Einzelnachweise
Literatur
- Alexander H. Lucas (2001): Immunoglobulin Gene Construction. In: Encyclopedia of Life Sciences. doi:10.1038/npg.els.0001172 (Volltextzugriff)
- Stefan Dübel et al. (2004): Rekombinante Antikörper: Werkzeuge gegen Krebs, Infektionen und Autoimmunerkrankungen? In: Biologie in unserer Zeit. Bd. 34, S. 372–379. doi:10.1002/biuz.200410267 PDF
- Dübel, S. (ed.) (2007) Handbook of Therapeutic Antibodies. Three Vol., 1160pages. Wiley-VCH, Weinheim, ISBN 978-3-527-31453-9.
Siehe auch
Wikimedia Foundation.