- Ionon
-
Strukturformel -alpha-Ionon_svg.png)
-alpha-Ionon_svg.png)
(R)-α-Jonon (S)-α-Jonon
β-Jonon
-gamma-Ionon_svg.png)
-gamma-Ionon_svg.png)
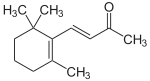
(R)-γ-Jonon (S)-γ-JononAllgemeines Name Jonon Andere Namen - Ionon
α-Jonon:
- Violon
- E-Megastigma-4,7-dien-9-on
- (E)-4-(2,6,6-Trimethyl-2-cyclohexen-1-yl)- 3-buten-2-on
β-Jonon:
- Boronion
- E-Megastigma-5(13),7-dien-9-on
- (E)-4-(2,6,6-Trimethyl-1-cyclohexen-1-yl)- 3-buten-2-on
γ-Jonon:
- E-Megastigma-4,7-dien-9-on
- (E)-4-(2-Methylen-6,6-Dimethyl-cyclohexan-1-yl)- 3-buten-2-on
Summenformel C13H20O CAS-Nummer - 8013-90-9 (Gemisch)
- α: 127-41-3
- β: 79-77-6
- γ: 24190-32-7
Kurzbeschreibung farblose, stark riechende Flüssigkeit Eigenschaften Molare Masse 192,30 g·mol−1 Aggregatzustand flüssig
Dichte Schmelzpunkt β: −49°C[2]
Siedepunkt Dampfdruck Löslichkeit sehr schlecht in Wasser (α, β)[4]
Sicherheitshinweise Gefahrstoffkennzeichnung [1][2] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: keine S-Sätze WGK α: 2[1]
β: 2[3]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Die Jonone (α-, β-, und γ-Jonon) sind zu den Terpenen gehörende Moleküle. Sie haben einen veilchenartigen Geruch und sind weit verbreitete Naturstoffe, die in vielen Pflanzen vorkommen.
Inhaltsverzeichnis
Geschichte
1893 wurde von Wilhelm Haarmann für die Firma Haarmann & Reimer ein Verfahren zu Synthese von α- und β-Jonon aus Citral (siehe Gewinnung und Darstellung) entwickelt und patentiert.
Vorkommen
Alle drei Jononarten sind in Ölen diverser Pflanzen, insbesondere in Beeren, Tee und Tabak, gefunden worden. Veilchenöl enthält ca. 22% α-Jonon, β-Jonon wird beispielsweise im Hennastrauch gefunden, die Tamarinde enthält γ-Jonon. β-Jonon ist ein Abbauprodukt von β-Carotin.
Vom α-Jonon werden beide optischen Isomere in der Natur gefunden.
Gewinnung und Darstellung
Es kann entweder aus entsprechenden Pflanzenölen gewonnen oder auch synthetisch hergestellt werden.
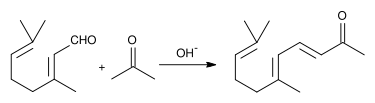
Zur Herstellung von α- und β-Jonon wird Citral im basischen Milieu mit Aceton kondensiert. Hierbei entsteht Pseudojonon.
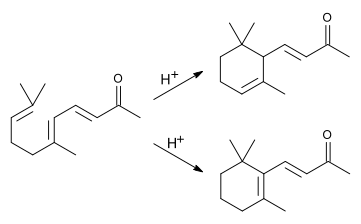
Dieses lässt sich beim Erwärmen mit verdünnter Säure zu einem Gemisch aus α- und β-Jonon cyclisieren.
Je nach Reaktionsbedingungen ändert sich das Verhältnis von α- zu β-Jonon. Bei der Cyclisierung mit Phosphorsäure entsteht hauptsächlich α-Jonon, mit Schwefelsäure β-Jonon.
Durch die Umsetzung von Pseudojonon mit Bortrifluorid und konzentrierter Essigsäure lässt sich mit hoher Ausbeute reines β-Jonon herstellen.
Eigenschaften
Physikalische Eigenschaften
Physikalische Eigenschaften der einzelnen Enantiomeren[5]
- (D)-α-Jonon
- Optische Aktivität [α]23 °CD +347°
- Brechungsindex 1,5016 (20 °C)
- (DL)-α-Jonon
- Optische Aktivität [α]25 °CD 0°
- Brechungsindex 1,5041 (20 °C)
- (L)-α-Jonon
- Optische Aktivität [α]27 °CD −406°
- Brechungsindex 1,5000 (25 °C)
- β-Jonon
- Optische Aktivität [α]27 °CD 0°
- Brechungsindex 1,5198 (20 °C)
Chemische Eigenschaften
Durch Ultraviolettstrahlung lässt sich die normalerweise in der trans-Konfiguration vorliegende Doppelbindung der Seitenkette in die cis-Konfiguration überführen.
Verwendung
Jonon wird in großen Mengen in der Riechstoffindustrie, zumeist in Blumen- oder Phantasie-Kompositionen, eingesetzt. Je nach Anwendungsbereich werden hier Isomerengemische oder einzelne Isomeren, welche sich alle im Duft unterscheiden, verwendet. Auch für die Herstellung von Aromen werden im geringeren Umfang Jonone eingesetzt.
Auch dienen sie zur Herstellung der in der Parfümerie wichtigen Damascenonen und Isomethyljononen.
β-Jonon ist außerdem eine wichtige Ausgangssubstanz für die Produktion von Retinol und Carotinen.
Biologische Bedeutung
Jonone können vom Menschen noch in sehr geringen Konzentrationen gerochen werden. Für β-Jonon liegt die Geruchsschwelle bei 10−7 mg pro Liter Luft oder 0,1 ppb, für (R)-γ-Jonon bei 11 ppb und bei (S)-γ-Jonon 0,07 ppb.[6]
Sicherheitshinweise
Der LD50-Wert (Ratte, oral) liegt für α-Jonon bei 4590 mg/kg, für β-Jonon bei 2920 mg/kg.
Jonone besitzen ein allergenes Potential und sollten deshalb wenn möglich mit Handschuhen gehandhabt werden.
α-Jonon ist außerdem in der Wassergefährdungsklasse 2 (wassergefährdend) eingeteilt.
Quellen
- ↑ a b c d e Sicherheitsdatenblatt Merck
- ↑ a b c Sicherheitsdatenblatt Carl Roth
- ↑ a b Sicherheitsdatenblatt Sigma-Aldrich
- ↑ [1] Sicherheitsdatenblatt Acros
- ↑ CRC Handbook of Chemistry and Physics, 60th Edition, CRC Press, 1980
- ↑ Elisabetta Brenna, Claudio Fuganti, Stefano Serra, and Philip Kraft, Optically Active Ionones and Derivatives: Preparation and Olfactory Properties, Eur. J. Org. Chem. 2002, 967–978
- D. Martinetz: R. Hartwig, Taschenbuch der Riechstoffe. 1. Auflage, 1998, Verlag Harri Deutsch
- E. Breitmaier: Terpene. 1. Auflage, 1999, Teubner Studienbücher
- Hermann Römpp: Chemielexikon. 5. Auflage, 1962, Franckh'sche Verlagshandlung
- Römpp Lexikon Chemie – Version 2.0, 1999, Georg Thieme Verlag
- W. Walter, W. Francke: Lehrbuch der Organischen Chemie. 23. Auflage, 1998, S. Hirzel Verlag Stuttgart – Leipzig
Wikimedia Foundation.