- Methylamin
-
Strukturformel 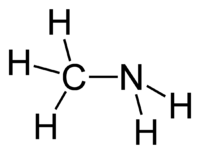
Allgemeines Name Methylamin Andere Namen - Aminomethan
- Monomethylamin
Summenformel CH5N CAS-Nummer 74-89-5 PubChem 6329 Kurzbeschreibung farbloses Gas mit ammoniakartigem Geruch[1]
Eigenschaften Molare Masse 31,06 g·mol–1 Aggregatzustand gasförmig
Dichte Schmelzpunkt Siedepunkt −6,3 °C[1]
Dampfdruck pKs-Wert pKb = 3.4[2]
Löslichkeit mischbar mit Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 



Gefahr
H- und P-Sätze H: 220-332-335-315-318 EUH: keine EUH-Sätze P: 210-261-280-305+351+338-410+403 [4] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 

Gesundheits-
schädlichHoch-
entzündlich(Xn) (F+) R- und S-Sätze R: 12-20-37/38-41 S: (2)-16-26-39 MAK 13 mg·m–3, 10 ppm[1]
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Methylamin ist das Amin des Methans. Es ist das einfachste organische Amin und besitzt die Summenformel CH5N. Es kommt als 40%ige wässrige Lösung und als druckverflüssigtes Gas in den Handel.
Inhaltsverzeichnis
Gewinnung und Darstellung
Die großtechnische Herstellung von Methylamin erfolgt durch die Umsetzung von Methanol und Ammoniak bei Temperaturen von 370 bis 430 °C und Drücken von 20 bis 30 bar. Die Reaktion wird in der Gasphase an sauren Heterogenkatalysatoren auf der Basis von Silicium-Aluminium-Oxiden durchgeführt. Als Reaktionsprodukte entstehen neben Methylamin und Wasser noch Dimethylamin (CH3)2NH und Trimethylamin (CH3)3N:
Bildung der Nebenprodukte:
Die Reinigung und Aufarbeitung des Reaktionsgemisches erfolgt durch mehrstufige Destillation unter Druck.
Eigenschaften
Bei Raumtemperatur ist Methylamin ein farbloses, hochentzündliches Gas mit intensivem Geruch. Es lässt sich durch Abkühlen oder Druckerhöhung verflüssigen. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,51990, B = 1034,977 und C = −37.574 im Temperaturbereich von 190 K bis 267 K.[5] Methylamin ist löslich in Methanol und Wasser. In Wasser reagiert Methylamin als Base und bildet mit Säuren lösliche Salze. Methylamin reagiert durch den +I-Effekt der Methylgruppe als starke Base (pKb = 3,4).
Verwendung
Durch Umsetzung mit Alkylierungsmitteln, Epoxiden, Carbonylverbindungen, organischer Säuren usw. kann Methylamin zu zahlreichen Folgeverbindungen umgesetzt werden. Methylamin findet Verwendung in Synthese vielerlei Produkte wie Lösungsmittel, Pflanzenschutzmittel, Pharmazeutika und Farbstoffe, wie z.B. N-Methyl-2-pyrrolidon (NMP), N-Methylformamid, Coffein, Ephedrin, Methamphetamin und N,N'-Dimethylharnstoff.
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Methylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29.12.2007 (JavaScript erforderlich)
- ↑ Patent EP1325936
- ↑ a b Eintrag zu CAS-Nr. 74-89-5 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ Datenblatt Methylamine bei Sigma-Aldrich, abgerufen am 10. April 2011.
- ↑ Aston, J.G.; Siller, C.W.; Messerly, G.H.: Heat capacities and entropies of organic compounds. III. Methylamine from 12K to the boiling point. Heat of vaporization and vapor pressure. The entropy from molecular data in J. Am. Chem. Soc. 59 (1937) 1743-1751. doi:10.1021/ja01288a054
Kategorien:- Feuergefährlicher Stoff
- Gesundheitsschädlicher Stoff
- Amin
Wikimedia Foundation.



