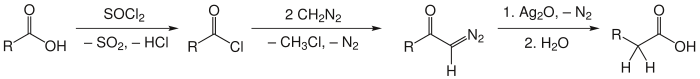- Arndt-Eistert-Homologisierung
-
Die Arndt-Eistert-Homologisierung oder auch Arndt-Eistert-Synthese ist eine Reaktion aus dem Bereich der Organischen Chemie. Dabei wird eine Carbonsäure in drei Stufen um eine Methylengruppe verlängert (homologisiert). Die dritte Stufe bezeichnet man auch als Wolff-Umlagerung.
Die Reaktion ist nach ihren Entdeckern Fritz Arndt (1885-1969) und Bernd Eistert (1902-1978) benannt.
Inhaltsverzeichnis
Übersicht
In der ersten Stufe wird die Carbonsäure in das korrespondierende Säurechlorid umgewandelt. Danach erfolgt die Addition der Methylengruppe, welche durch das Diazomethan bereitgestellt wird. Es entsteht ein α-Diazo-methylketon. Die dritte Stufe, die Wolff-Umlagerung, führt mit z.B. Silberoxid als Katalysator und Wasser zur Bildung der homologen Carbonsäure, es sind jedoch bei Austausch von Wasser durch andere Verbindungen andere Derivate möglich. (siehe unten)
Praktisch wird die Reaktion mit einem zusätzlichen Äquivalent Diazomethan durchgeführt, da das sich abspaltende HCl-Molekül an das Diazoketon addieren und ein α-Halogen-Keton ergeben kann. Das zusätzliche Äquivalent Diazomethan überführt HCl in Chlormethan, welches nicht mehr reaktiv genug ist.
Mechanismus
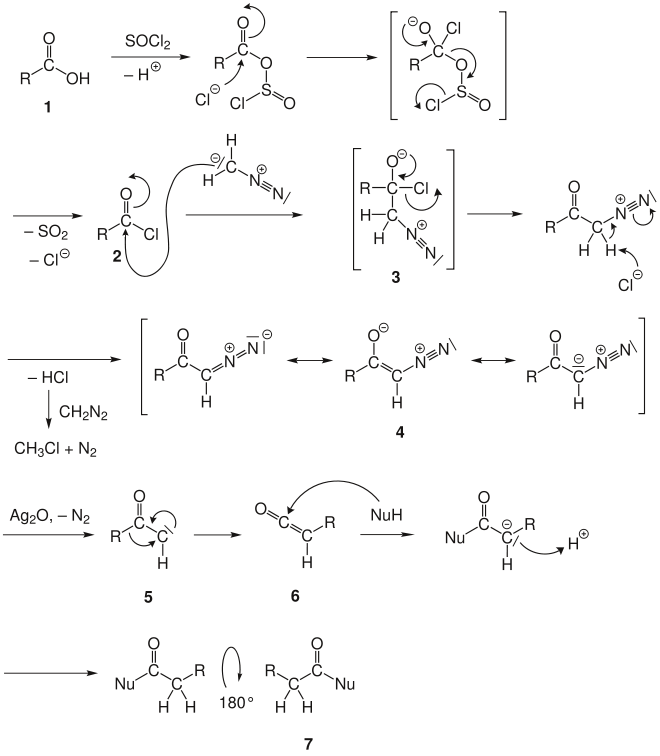
Aus der Carbonsäure 1 wird zunächst das Säurechlorid 2 gebildet. Danach erfolgt an dessen terminalem Kohlenstoffatom die nukleophile Addition der Methylengruppe des Diazomethans. Hierbei entsteht in einem Übergangszustand ein Diazoniumbetain 3, das unter Abspaltung von HCl in das mesomeriestabilisierte Diazoketon 4 übergeht (Addition-Eliminierungs-Mechanismus).
Diazoketone können bei erhöhter Temperatur mit Silber- und Kupfer-Katalysatoren unter Mitnahme der Bindungselektronen molekularen Stickstoff abspalten. Das Zwischenprodukt ist ein klassisches Carben 5. Unter einer Sextettumlagerung wandelt es sich in ein Keten 6 um.
Dieses Keten 6 kann mit verschiedenen H-aciden, nucleophilen Verbindungen in einer nucleophilen Addition umgesetzt werden:
- mit Wasser zu Carbonsäuren, wie unter "Überblick" angegeben
- mit Alkoholen zu Carbonsäureester
- mit Ammoniak (Aminen) zu (N-substituierten) Carbonsäureamiden
Siehe auch
Literatur
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie; S. Hirzel Verlag, Stuttgart-Leipzig 1998, 23. überarb. und aktualisierte Auflage; ISBN 3-7776-0808-4.
- László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis; Elsevier Academic Press, Burlington-San Diego-London 2005, 1. Edition; ISBN 0-12-369483-3.
Wikimedia Foundation.