- Diazomethan
-
Strukturformel 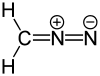
Allgemeines Name Diazomethan Andere Namen Azimethylen
Summenformel CH2N2 CAS-Nummer 334-88-3 PubChem 9550 Kurzbeschreibung gelbes, nach feuchtem Laub riechendes Gas [1]
Eigenschaften Molare Masse 42,04 g·mol−1 Aggregatzustand gasförmig
Dichte 1,45 g·cm−3 [1]
Schmelzpunkt Siedepunkt −23 °C [1]
Löslichkeit - Zersetzung in Wasser [1]
- löslich in Ethanol, Diethylether und Benzol[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung aus EU-Verordnung (EG) 1272/2008 (CLP) [3] 
Gefahr
H- und P-Sätze H: 350 EUH: keine EUH-Sätze P: ? EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [3] 
Giftig (T) R- und S-Sätze R: 45 S: 53-45 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Diazomethan (Summenformel CH2N2) ist die einfachste Diazoverbindung. Es wird auch Azimethylen genannt. Es ist ein im Labor oft benutztes Methylierungsmittel und wird insbesondere für die Herstellung von Methylestern aus den Carbonsäuren und in der Synthese von Cyclopropanen aus Alkenen benutzt. Die technische Anwendung ist durch die hohe Giftigkeit und Reaktivität sehr begrenzt.[4]
Inhaltsverzeichnis
Darstellung
Diazomethan lässt sich durch Reaktion von N-Methyl-Nitroso-Verbindungen wie Nitrosomethylharnstoff oder N-Methyl-N-nitroso-p-toluolsulfonamid mit Basen wie Natrium- oder Kaliumhydroxid in Diethylether herstellen. Dabei bildet sich zunächst ein Diazotat, das durch die Base in Diazomethan und Wasser zersetzt. Dabei wird das Diazomethan mit dem Ether abdestilliert.[5][6]
Eigenschaften
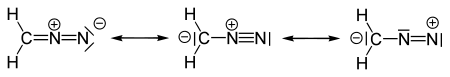
Zur Beschreibung der Molekülstruktur von Diazomethan werden drei so genannte mesomere Grenzstrukturen herangezogen:[4]
Es gibt zudem eine ringförmige Struktur, die unter dem Namen Diazirin bekannt ist (und anfangs dem Diazomethan zugeordnet wurde[7]), aber vollkommen andere physikalische und chemische Eigenschaften besitzt. Weitere isomere Formen des Diazomethans sind Isoknallsäureamid (H2N-NC) und Isodiazomethan (HCNNH), welche nur in komplexstabilisiertem Zustand stabil sind.
Bei Raumtemperatur ist Diazomethan ein gelbes Gas, das nach feuchtem Laub riecht.[1] Es ist sowohl als Gas als auch als Flüssigkeit äußerst explosiv.[5] Darum wird es meist als Lösung in Diethylether hergestellt und verwendet. Die etherische Lösung ist nicht stabil, das Diazomethan zersetzt sich langsam unter Stickstoffabgabe. Explosionsgefahr besteht vor allem bei Kontakt zu rauen Glasoberflächen und Metallen. Diazomethan reagiert mit Alkalimetallen, Calciumchlorid, Kupferpulver und Natriumsulfid explosiv.[1]
Die chemisch charakteristische Reaktion ist die Methylierung, bei der Diazomethan mit geeigneten Nukleophilen unter Stickstoffabgabe reagiert.
Toxizität
Diazomethan ist giftig und im Tierversuch krebserzeugend. Der Hauptaufnahmeweg von Diazomethan sind die Atemwege, wo es direkt mit dem Gewebe reagiert. Akut verursacht es Verätzungen, über eine chronische Toxizität ist wenig bekannt.[1]
Verwendung
Diazomethan ist ein starkes Methylierungsmittel und wird ausschließlich als Lösung in Diethylether im kleineren Maßstab verwendet. Es ist ein sehr starkes Elektrophil und besitzt mit N2 eine gute Abgangsgruppe. Es eignet sich insbesondere für die einfache und effektive Herstellung von Methylestern der Carbonsäuren. Die Methylierung ist dabei im Gegensatz zu anderen Methylierungen auch im schwach Sauren möglich.[8] Weiterhin kann es für Ringerweiterungen[9], die Arndt-Eistert-Homologisierung zur Verlängerung von Kohlenstoffketten um ein weiteres C-Atom[10] und [1,3]-dipolare Cycloadditionen[11] genutzt werden.
Verwendet man Bortrifluorid als Katalysator, so lassen sich mit Diazomethan alkoholische Hydroxygruppen (–OH) in Methoxygruppen (–OCH3) umwandeln. Phenole reagieren mit Diazomethan dagegen auch ohne Bortrifluorid-Katalysator.[12]
Die Addition von Diazomethan an C–C-Doppelbindungen, etwa in Acrylnitril führt zur Bildung von Pyrazolin-Ringen.[13]
Einzelnachweise
- ↑ a b c d e f g h Eintrag zu Diazomethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Juni 2008 (JavaScript erforderlich)
- ↑ Hans Beyer, Wolfgang Walter, Wittko Francke: Lehrbuch der Organischen Chemie. 23. Auflage, S. Hirzel Verlag 1998, ISBN 3-7776-0808-4.
- ↑ a b Eintrag zu CAS-Nr. 334-88-3 im European chemical Substances Information System ESIS (ergänzender Eintrag)
- ↑ a b Klaus Forstinger, Hans Joachim Metz: Diazo Compounds and Diazo Reactions. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a08 505.
- ↑ a b Arnold Willmes: Taschenbuch chemische Substanzen: Elemente- Anorganika- Organika- Naturstoffe- Polymere. 3. Auflage, Harri Deutsch Verlag, 2007, ISBN 978-3-8171-1787-1, S. 379-382.
- ↑ James A. Moore, Donald E. Reed: Diazomethane. In: Organic Syntheses. 1973, Vol. 5, S. 351 (Volltext).
- ↑ Diazirine. In: Römpp Chemie-Lexikon. Georg Thieme Verlag Stand März 2002.
- ↑ Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9, S. 97.
- ↑ Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9, S. 607.
- ↑ Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9, S. 351.
- ↑ Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9, S. 668.
- ↑ Adalbert Wollrab: Organische Chemie: Eine Einfuhrung fur Lehramts- und Nebenfachstudenten. 3. Auflage. Springer, 2009, ISBN 978-3-642-00780-4, S. 440.
- ↑ Hans Peter Latscha, Uli Kazmaier, Helmut Alfons Klein: Organische Chemie: Chemie-basiswissen II, Band 2. 6. Auflage, Springer, 2008, ISBN 978-3-540-77106-7, S. 83.
Wikimedia Foundation.