- Natriumlaurylsulfat
-
Strukturformel 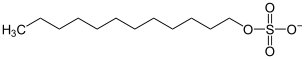
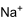
Allgemeines Name Natriumlaurylsulfat Andere Namen - SLS
- SDS
- Natriumdodecylsulfat
- Dodecylsulfat-Natriumsalz
- Schwefelsäuredodecylester-Natriumsalz
- SODIUM LAURYL SULFATE (INCI)
Summenformel C12H25NaO4S CAS-Nummer 151-21-3 PubChem 3423265 Kurzbeschreibung fest, farblos, geruchlos[1]
Eigenschaften Molare Masse 288,4 g·mol−1 Aggregatzustand fest
Dichte 1,1 g·cm−3 (20 °C)[2]
Schmelzpunkt Siedepunkt 380 °C (Thermische Zersetzung)[1]
Löslichkeit gut löslich in Wasser (150 g·l−1 bei 20 °C)[2]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 

Gefahr
H- und P-Sätze H: 228-311-302-335-315-319 EUH: keine EUH-Sätze P: 210-280-304+340-305+351+338-309+310 [2] EU-Gefahrstoffkennzeichnung [2] 

Leicht-
entzündlichGesundheits-
schädlich(F) (Xn) R- und S-Sätze R: 11-21/22-36/37/38 S: 26-36/37 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Natriumlaurylsulfat oder Natriumdodecylsulfat ist ein anionisches Tensid, also eine waschaktive Substanz, das als Detergens Verwendung findet, z. B. in Shampoo. Chemisch ist Natriumlaurylsulfat ein Monoester der Schwefelsäure, bestehend aus einer langkettigen (C12) Alkylgruppe und einem modifizierten Sulfatanion mit einem Natriumkation.
Inhaltsverzeichnis
Gewinnung und Darstellung
Natriumlaurylsulfat kann durch Veresterung von Dodecanol mit Schwefelsäure, Chlorsulfonsäure oder Schwefeltrioxid und nachfolgender Neutralisation gewonnen werden. Ebenso ist die Addition von Schwefelsäure an 1-Dodecen möglich. Da die verwendeten Ausgangsprodukte meist technische Fettalkohole sind, die zum Beispiel aus den entsprechenden Fetten bzw. Fettsäuren reduktiv gewonnenen werden, enthalten die meisten Handelsprodukte neben Dodecyl- auch Tetradecyl- und Hexadecylketten in unterschiedlichen Anteilen. In technischen Merkblättern sind die entsprechenden Produkte häufig mit dem Zusatz (C12-C16) gekennzeichnet.
Eigenschaften
Natriumlaurylsulfat wird als allergieauslösend und hautreizend betrachtet, weswegen seine Verwendung in Kosmetika umstritten ist. Insbesondere wird von Menschen mit spezieller Empfindlichkeit die Verursachung von Aphthen im Mundraum durch Natriumlaurylsulfat-haltige Zahnpasten beobachtet. Allerdings weist SDS eine antibakterielle und antivirale Wirkung auf. Inwiefern es in der Lage ist, HI-Viren zu zerstören, wie geltend gemacht wurde[3], bleibt zu klären.
Verwendung
Natriumlaurylsulfat dient in den meisten Shampoos und Duschgelen als reinigende Komponente. Darüber hinaus wird Natriumlaurylsulfat als Emulgator in Salben und Lotionen sowie Reinigungsmitteln, vor allem in Handspülmitteln und flüssigen Waschmitteln verwendet.
Die intensive Anwendung als Denaturierungsmittel für Proteine ist ein Grund für die Bedeutung von Natriumlaurylsulfat in höheren Konzentrationen für die Biotechnologie. Die Wirkung auf Proteine basiert darauf, dass nichtkovalente Bindungen der Proteine unterbrochen und so deren Quartär- und Tertiärstruktur zerstört werden. Dabei bindet Natriumlaurylsulfat im Verhältnis von ca. 1,4/1 g. Durch die Eigenschaft, Mizellen auszubilden, sind Natriumlaurylsulfat-Protein-Lösungen nicht dialysierbar; eine Entfernung von Natriumlaurylsulfat ist durch Fällungsreaktionen mit organischen Lösungsmitteln möglich (siehe Henderson, 1979).
In der Analytik wird Natriumlaurylsulfat bei der Polyacrylamid-Gelelektrophorese (SDS-PAGE) verwendet.[4]
Nachweis
Siehe auch
Literatur
- L. E. Henderson, S. Oroszlan, W. Konigsberg: A Micromethod for Complete Removal of Dodecyl Sulfate from Proteins by Ion-Pair Extraction, in: Analytical Biochemistry, 1979, 93, S. 153–157.
Einzelnachweise
- ↑ a b Datenblatt Natriumlaurylsulfat bei Merck, abgerufen am 17. Januar 2008.
- ↑ a b c d e f g Eintrag zu Natriumdodecylsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Juli 2011 (JavaScript erforderlich).
- ↑ planetark.org.
- ↑ U. K. Laemmli: Cleavage of structural proteins during the assembly of the head of bacteriophage T4, in: Nature, 1970, 227, S. 680–685.
Weblinks
Kategorien:- Giftiger Stoff
- Gesundheitsschädlicher Stoff
- Feuergefährlicher Stoff
- Schwefelsäureester
- Natriumverbindung
- Pharmazeutischer Hilfsstoff
- Tensid
- Elektrophorese
- Kosmetischer Inhaltsstoff
Wikimedia Foundation.
