- Nitrobenzoylchloride
-
Nitrobenzoylchloride Name 2-Nitrobenzoylchlorid 3-Nitrobenzoylchlorid 4-Nitrobenzoylchlorid Andere Namen o-Nitrobenzoylchlorid m-Nitrobenzoylchlorid p-Nitrobenzoylchlorid Strukturformel 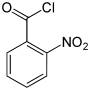
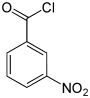
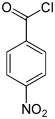
CAS-Nummer 610-14-0 121-90-4 122-04-3 PubChem 11875 8495 8502 Summenformel C7H4ClNO3 Molare Masse 185,57 g·mol−1 Aggregatzustand flüssig fest Kurzbeschreibung gelbliche Flüssigkeit
gelbliches kristallines
Pulvergelbes kristallines
PulverSchmelzpunkt 17–20 °C[1] 29 °C[2] 72–74 °C[3] Siedepunkt 148–149 °C
(9 mmHg)[1]278 °C[2]
155 °C
(20 mbar)[3]GHS-
Einstufung
[1][2][3]
Gefahr
Gefahr

Gefahr
H- und P-Sätze 314 312-314 290-314 keine EUH-Sätze keine EUH-Sätze keine EUH-Sätze 280-305+351+338-310 280-303+361+353
305+351+338-310280-301+330+331
305+351+338-309+310Gefahrstoff-
kennzeichnung
[1][2][3]
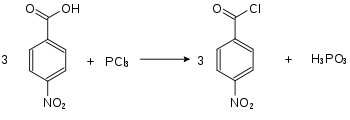
Ätzend (C) R-Sätze 5-34 21-34 34 S-Sätze 26-36/37/39-45 26-36/37/39-45 26-36/37/39-45 Die Nitrobenzoylchloride bilden in der Chemie eine Stoffgruppe, die sich sowohl vom Benzoylchlorid als auch vom Nitrobenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter –COCl-Gruppe und Nitrogruppe (–NO2) als Substituenten. Durch deren unterschiedliche Anordnung (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C7H4NO3Cl. Das 4-Nitrobenzoylchlorid findet Verwendung in der Analyse organischer Substanzen.
Inhaltsverzeichnis
Darstellung
Die Nitrobenzoylchloride erhält man aus den Nitrobenzoesäuren durch Umsetzung mit Thionylchlorid (SOCl2)[4][5] oder Phosphortrichlorid (PCl3)[5].
Eigenschaften
Die Nitrobenzoylchloride sind gelbliche Flüssigkeiten bzw. kristalline Feststoffe mit stechendem Geruch. Das 4-Nitrobenzoylchlorid, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt.
Verwendung
Das 4-Nitrobenzoylchlorid findet vor allem Verwendung in der Analyse organischer Substanzen durch Derivatisierung. Es wird den Fällen eingesetzt, wenn ein fraglicher Stoff empfindlicher ist und eine direkte Veresterung mit 4-Nitrobenzoesäure in Gegenwart von Schwefelsäure nicht möglich ist. In der Regel erfolgt die Umsetzung in Pyridin, um das freiwerdende HCl sofort zu binden.[6]
Einzelnachweise
- ↑ a b c d Datenblatt 2-Nitrobenzoylchlorid bei Sigma-Aldrich, abgerufen am 4. Mai 2011.
- ↑ a b c d Eintrag zu 3-Nitrobenzoylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Mai 2011 (JavaScript erforderlich).
- ↑ a b c d Eintrag zu 4-Nitrobenzoylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 4. Mai 2011 (JavaScript erforderlich).
- ↑ Gattermann / Wieland: Die Praxis des organischen Chemikers, 43. Auflage, Walter de Gruyter, Berlin · New York 1982, ISBN 3-11-006654-8, S. 304: "p-Nitrobenzoylchlorid".
- ↑ a b Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 440.
- ↑ Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 424.
Siehe auch
Wikimedia Foundation.