- Oxol
-
Strukturformel 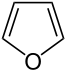
Allgemeines Name Furan Andere Namen - Furfuran
- Divinylenoxid
- Oxacyclopentadien
- Oxol
Summenformel C4H4O CAS-Nummer 110-00-9 PubChem 8029 Kurzbeschreibung farblose Flüssigkeit Eigenschaften Molare Masse 68,08 g·mol−1 Aggregatzustand flüssig
Dichte 0,94 g·cm−3 [1]
Schmelzpunkt Siedepunkt 32 °C [1]
Dampfdruck Löslichkeit schlecht in Wasser (10 g·l−1 bei 20 °C) [1]
Sicherheitshinweise Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [2] 

Hoch-
entzündlichGiftig (F+) (T) R- und S-Sätze R: 45-12-19-20/22-38-48/22-52/53-68 S: 53-45-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Furan (Furfuran) ist eine in Wasser schlecht lösliche organische Flüssigkeit.
Inhaltsverzeichnis
Geschichte
Der Name Furan leitet sich vom lateinischen Wort furfur für Kleie ab.[3] Das erste Furan-Derivat wurde Furan-2-carbonsäure von dem Chemiker Carl Wilhelm Scheele 1780 hergestellt. Von einem weiteren wichtigen Derivat namens Furfural wurde von Johann Wolfgang Döbereiner 1831 berichtet und neun Jahre später vom schottischen Chemiker John Stenhouse charakterisiert. Furfuran wurde durch den Chemiker Heinrich Limpricht 1870 hergestellt. Er nannte es fälschlicherweise Tetraphenol.[4][5]
Die Weltgesundheitsorganisation (WHO) hat Furan als möglicherweise Krebs erregend für den Menschen eingestuft. Die genaue Wirkung im menschlichen Körper muss allerdings noch geklärt werden.
Gewinnung und Darstellung
Furan wird technisch aus Furfural (Furan-2-aldehyd) hergestellt, das selbst wiederum durch Destillation aus Kleie und Schwefelsäure gewonnen werden kann. Für die Decarbonylierung des Furfurals wird es zusammen mit Zinkoxid und Chrom(III)-oxid auf 400 °C erhitzt. In einem alternativen Syntheseweg wird das Furfural zunächst mit Sauerstoff zur Furan-2-carbonsäure oxidiert und anschließend durch eine Decarboxylierung zu Furan umgesetzt.[6]
Eigenschaften
Es ist ein Aromat, ein Fünfring mit Sauerstoff als Heteroatom. Es besitzt 6 pi-Elektronen, 4 von den Doppelbindungen und 2 von einem freien Elektronenpaar des sp2-hybridisierten Sauerstoffs. Somit gehört es zu den Heteroaromaten und zu den Heterocyclen. Der aromatische Charakter ist jedoch schwächer als bei Pyrrol und Thiophen ausgeprägt.
Furan hat einen niedrigen Siedepunkt (32 °C) und schon bei Raumtemperatur einen hohen Dampfdruck. Es ist brennbar und – wegen des hohen Dampfdrucks – hochentzündlich.
Verwendung
Eine wichtige Reaktion des Furans ist die Hydrierung zum cyclischen Ether Tetrahydrofuran, der oft als Lösungsmittel verwendet wird.
Furanharze werden beim Gießen, mit Sand vermischt, als Formwerkstoff in den Formkästen eingesetzt.
Derivate
Furanderivate kommen in Aromen und Riechstoffen vor und wirken in der Natur als Pheromone.
Ähnliche Strukturen bilden einige Kohlenhydrate (Zucker), diese werden als Furanosen bezeichnet, enthalten jedoch keine Doppelbindungen im Ring.
Siehe auch
- Benzofuran, Furan mit einem kondensierten Benzolring.
- Dibenzofuran, die Grundstruktur der Stoffklasse der polychlorierten Dibenzofurane.
- Furanocumarine
- Pyrrol, die Entsprechung des Furans, die Stickstoff enthält statt Sauerstoff.
- Tetrahydrofuran (THF), die vollständig hydrierte Entsprechung des Furans und ein gebräuchliches Lösungsmittel.
- Thiophen, die Schwefel-Entsprechung des Furans.
- 2,5-Dimethylfuran
Quellen
- ↑ a b c d e Eintrag zu Furan in der GESTIS-Stoffdatenbank des BGIA, abgerufen am 16. Mai 2008 (JavaScript erforderlich)
- ↑ Eintrag zu CAS-Nr. 110-00-9 im European chemical Substances Information System ESIS
- ↑ Alexander Senning. Elsevier's Dictionary of Chemoetymology. Elsevier, 2006. ISBN 0-444-52239-5.
- ↑ H. Limpricht: Ueber das Tetraphenol C4H4O. In: Berichte der deutschen chemischen Gesellschaft. 3, Nr. 1, 1870, S. pp. 90–91. doi:10.1002/cber.18700030129
- ↑ Ernest Harry Rodd: Chemistry of Carbon Compounds: A Modern Comprehensive Treatise. Elsevier 1971
- ↑ Eberhard Breitmaier, Günther Jung: Organische Chemie. 4. Auflage, Thieme, Stuttgart 2001, ISBN 3-13-541504-X, S. 644.
Wikimedia Foundation.

