- Atovaquon
-
Strukturformel 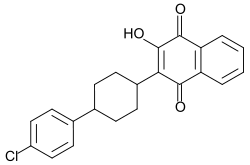
Allgemeines Freiname Atovaquon Andere Namen IUPAC: 2-[trans-4-(4-Chlorphenyl)cyclohexyl]-3-
-hydroxy-1,4-naphthochinonSummenformel C22H19ClO3 CAS-Nummer 95233-18-4 PubChem 74989 ATC-Code P01AX06
DrugBank DB01117 Arzneistoffangaben Wirkstoffklasse Verschreibungspflichtig: ja Eigenschaften Molare Masse 366,84 g·mol−1 Dichte Schmelzpunkt Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [3] keine GHS-Piktogramme H- und P-Sätze H: keine H-Sätze EUH: keine EUH-Sätze P: keine P-Sätze [3] EU-Gefahrstoffkennzeichnung [3]
N
Umwelt-
gefährlichR- und S-Sätze R: 50/53 S: 60-61 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Atovaquon ist ein Arzneistoff, der zur Therapie von Protozoen-Erkrankungen, wie der Malaria und der Toxoplasmose sowie der durch den Pilz Pneumocystis jirovecii verursachten Pneumocystis-Pneumonie (PCP) eingesetzt wird. Sein Wirkmechanismus beruht auf einer durch Strukturanalogie zu Ubichinon (Coenzym Q) bedingten Störung der Nukleinsäuresynthese des Krankheitserregers. Atovaquon wird von der Firma GlaxoSmithKline als Monotherapeutikum unter dem Markennamen Wellvone® zur Behandlung der Pneumocystis-Pneumonie und in Kombination mit Proguanil unter dem Markennamen Malarone[4][5][6] zur Chemoprophylaxe und Therapie der Malaria angeboten. Atovaquon unterliegt der ärztlichen Verschreibungspflicht.
Inhaltsverzeichnis
Synthese
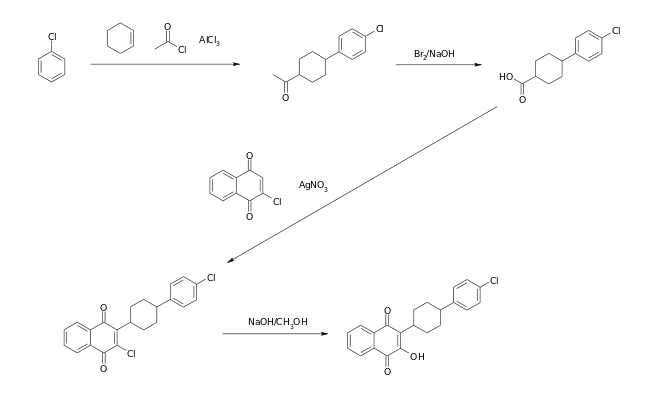
Die Synthese von Atovaquon startet mit einer Friedel-Crafts-Acylierung von Chlorbenzol mittels Acetylchlorid in Gegenwart von Cyclohexen. Das resultierende Chlorphenylcyclohexylmethylketon wird mit Brom zur substituierten Cyclohexancarbonsäure oxydiert. Im dritten Schritt erfolgt eine oxydative Kupplung mit 2-Chlor-1,4-naphthochinon. Das Zielmolekül wird durch die anschließende Hydrolyse mit methanolischer Natronlauge erhalten.[7]
Eigenschaften
Atovaquon ist ein gelblicher, kristalliner Feststoff[1], der in drei polymorphen Formen auftreten kann.[2] Form I zeigt beim Aufheizen bei 197 °C eine enantiotrope Umwandlung in die Form III. Ein ähnliches Verhalten zeigt die Form II, welche sich schon bei 169 °C enantiotrop in Form III umwandelt. Form III zeigt bis zum Schmelzpunkt bei 222 °C keine Festphasenumwandlung. Die Schmelzenthalpie beträgt 35 kJ·mol-1.[1] Die Formen I und II stehen monotrop zueinander. Bei Raumtemperatur ist die Form I die thermodynamisch stabile Form. Alle drei Formen können mittels einer Lösungsmittelkristallisation gewonnen werden.[2] Die Formen I und III bilden beide ein monoklines Kristallsystem und unterscheiden sich hinsichtlich der Raumgruppe mit P21/n für I und P21/c für III.[1]
Einzelnachweise
- ↑ a b c d e f L. Malpezzi, C. Fuganti, E. Maccaroni, N. Masciocchi, A. Nardi: Thermal and structural characterization of two polymorphs of Atovaquone and of its chloro derivative in J. Therm. Anal. Calorim. 102 (2010) 203–210, doi:10.1007/s10973-010-0685-0
- ↑ a b c Venkataswubramanian R. Tarur: Noval Polymorphs of Atovaquone and Process of, US-Patent 2006/0241311 A1, 26. Oktober 2006
- ↑ a b c Datenblatt Atovaquon bei Sigma-Aldrich, abgerufen am 9. März 2011.
- ↑ Rote Liste, Stand: August 2009
- ↑ AM-Komp. d. Schweiz, Stand: August 2009
- ↑ AGES-PharmMed, Stand: August 2009
- ↑ H. Hager, F. von Bruchhausen, S. Ebel, U. Holzgrabe: Hagers Handbuch der pharmazeutischen Praxis, Band 4, S. 122, Springer Verlag Berlin 1998, ISBN 978-3-540-62644-2
Weblinks

Bitte den Hinweis zu Gesundheitsthemen beachten! Kategorien:- ATC-P01
- Umweltgefährlicher Stoff
- Antiprotozoikum
- Arzneistoff
- Aromat
- Chinon
- Chloraromat
- Cyclohexan
- Enol
Wikimedia Foundation.