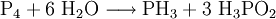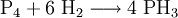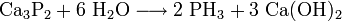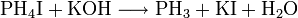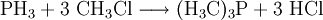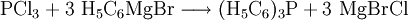- Phosphorylverbindungen
-
Die Bezeichnungen Phosphane und Phosphine werden synonym für dieselbe Verbindungsklasse verwendet. Die dazu gehörigen Verbindungen bestehen aus einem dreiwertigen Phosphoratom oder Ketten aus mehreren solcher Atome, an die Wasserstoff oder organische Gruppen als Substituenten gebunden sind. Phosphin ist der ältere und gängigere Name, der aber nicht mehr IUPAC-konform ist (er hat sich eingebürgert, weil das leichtere Pentelen sich Amin nennt). Im folgenden wird nur noch der IUPAC-Name Phosphan verwendet.
Inhaltsverzeichnis
Struktur
Die Phosphane zeigen eine Vielfalt an Strukturen. Lineare Phosphane sind bis zu einer Kettenlängen von sechs Phosphoratomen bekannt. Sie sind ähnlich wie die Alkane aufgebaut, jedoch weist das Phosphoratom als vierten Substituenten jeweils ein Elektronenpaar auf. Daher haben sie die allgemeine Summenformel PnHn+2. Wie bei den Kohlenwasserstoffen treten auch ringförmige Phosphane auf. Besonders ausgeprägt sind jedoch käfigartige Strukturen, die relativ häufig auch ansonsten ungewöhnliche, weil instabile Dreierringe enthalten. Allen Phosphanen – außer dem Monophosphan – ist gemein, dass sie aus einem Gerüst aus Phosphoratomen bestehen, die über Einfachbindungen verknüpft sind.[1]
Nomenklatur
Die Gruppe an Phosphanen, die nur aus Wasserstoff und Phosphor bestehen, nennen sich auch Phosphorhydride. Die einfachste Verbindung aus dieser Gruppe ist Monophosphan (PH3). Analog zu den Boranen wird der Name der Phosphane aus einem der Anzahl der Phosphor-Atome entsprechenden griechischen Zahlwort, der Bezeichnung phosphan und einer in Klammern gestellten arabischen Ziffer für die Anzahl der Wasserstoff-Atome gebildet, beispielsweise Triphosphan(5) für P3H5 oder Heptaphosphan(3) für P7H3. An dieser Stelle sei angemerkt, dass die entsprechende fünfwertige Verbindung PH5, das sogenannte Phosphoran nicht existiert. Auch bei den organischen Derivaten ist eine entsprechend Fünfbindigkeit nur selten vertreten (z. B. bei PPh5).
Organische Derivate des Monophosphans (PH3) entstehen formal durch den Austausch des Wasserstoffs (H) gegen organische Reste – allgemein mit R bezeichnet. Die von den Phosphanen abgeleitete funktionelle Gruppe wird Phosphino-Gruppe genannt. Je nachdem, ob Phosphane ein (PH2R), zwei (PHR2) oder drei (PR3) organische Reste tragen, spricht man wie bei den Aminen von primären, sekundären bzw. tertiären Phosphanen. Phosphane, die kurze Alkylgruppen tragen, wie Trimethylphosphin ((H3C)3P) sind unangenehm riechende Flüssigkeiten. Sie sind sehr reaktionsfähig und neigen zur Selbstentzündung. Triarylphosphine wie (H5C6)3P sind Festsubstanzen, die schwache basische Eigenschaften aufweisen. Sie reagieren leicht unter Aufnahme eines weiteren organischen Restes zu Phosphoniumsalzen. Organophosphorverbindungen, die drei Bindungseinheiten P-O-C enthalten, nennt man Phosphite (Formel: P(OR)3).
Eigenschaften
Phosphor-Wasserstoff-Verbindungen
Phosphane sind extrem giftige Substanzen. Die niedrigen Phosphane sind gasförmig, die höheren fest. Phosphane sind sehr reaktionsfähig. Sehr reines Monophosphan PH3 entzündet sich nicht von selbst. Wegen der Anwesenheit höherer Phosphane (v. a. Diphosphan) muss bei der Verwendung von kommerziell erhältlichem oder im Labor zubereiteten Monophosphan immer mit Selbstentzündung gerechnet werden. Monophosphan ist also neben der Giftwirkung auch in dieser Hinsicht ein extrem heikel zu handhabendes Gas. Diese Phosphorverbindungen haben einen extrem durchdringenden knoblauchartigen Geruch, der schon in geringsten Konzentrationen wahrnehmbar ist.
Organische Phosphane
Organische Phosphane mit kurzen Alkylgruppen sind flüssig und sehr luftempfindlich, z. T. auch lichtempfindlich (z. B. t-Bu3P, wegen einer alpha-H-Abstraktion). Auch sie haben einen durchdringenden Geruch – knoblauchartig ist nicht ganz die richtige Bezeichnung, aber es gibt ansonsten wenig Gerüche im Alltag, die diesem extrem unangenehmen Eindruck auch nur nahe kommen.
Die Basizität des Phosphans wird durch Alkylgruppen bedeutend gesteigert, und zwar in viel größerem Umfang, als dies bei Ammoniak der Fall ist. So beträgt der pKb-Wert von Phosphan 27, der von Triethylphosphan 5,31[2]. Im Vergleich hierzu steigen die pKb-Werte vom Ammoniak (4,75) zum Triethylamin (3,25) nur wenig an.
Triarylphosphane dagegen sind fest und wesentlich stabiler. Sie können im festen Zustand problemlos gelagert werden und sind erst in Lösung oxidationsempfindlich. Auch ist kein Geruch feststellbar, der allenfalls von Verunreinigungen durch primäre und sekundäre Phosphane aus der Herstellung stammt.Gewinnung/Darstellung
Monophosphan
Es gibt zahlreiche Möglichkeiten zur Darstellung von Monophosphan, z. B. disproportioniert weißer Phosphor (P4) im alkalischen Medium zu Phosphan und Phosphinsäure:
Analog zur Herstellung von Ammoniak im Haber-Bosch-Verfahren kann auch eine Synthese aus den Elementen erfolgen:
Im Labor lässt man Calciumphosphid mit Wasser reagieren:
Zuletzt ist Monophosphan auch aus Phosphoniumiodid und Kaliumhydroxid zugänglich:[3]
Organische Phosphane
Die Gewinnung von Phosphanen kann ausgehend von Monophosphan oder von Phosphortrichlorid erfolgen. In Substitutionsreaktionen werden Wasserstoff bzw. Chlor durch organische Reste ersetzt.
Monophosphan kann dabei mit Alkylhalogeniden oder Olefinen umgesetzt werden:
- Monophosphan reagiert mit Methylchlorid zu Trimethylphosphin und Chlorwasserstoff.
Ausgehend vom Phosphortrichlorid verwendet man Grignard- oder Lithium-organische Verbindungen:
- Phosphortrichlorid reagiert mit Phenylmagnesiumbromid zu Triphenylphosphin und Magnesiumbromid/Magnesiumchlorid.
Statt PCl3 ist die Verwendung von Phosphiten, z. B. P(OPh)3 oder P(OMe)3 (wobei Ph = Phenyl, -C6H5 und Me = Methyl, -CH3) von Vorteil, da diese nicht so sehr zu Nebenreaktionen neigen (Bildung von organischen Diphosphanen R2P-PR2) und angenehmer zu handhaben sind.
Zu erwähnen sein noch die Hydrophosphorylierung von Doppel- und Dreifachbindungen für die Darstellung von Phosphanen (unter basischer Katalyse oder photolytisch mit Radikalstarter (AIBN)):
Verwendung
Phosphane haben herausragende Bedeutung als Liganden in der homogenen Katalyse. Sie stabilisieren eine Vielzahl von Katalysatoren und ermöglichen durch ihre strukturelle Vielfalt eine Einstellung der Katalysator-Eigenschaften. Durch den Einsatz von chiralen Phosphanen ist die enantiomerenreine Darstellung vieler organischer Verbindungen (v. a. Pharmazeutika und deren Ausgangsverbindungen) erst ermöglicht worden. Auch bei der Herstellung von Kunststoffen werden häufig Katalysatoren verwendet, die Phosphanliganden enthalten oder für Olefinierungsreaktionen.
Phosphane werden aber auch als Reagenzien in einer Reihe von chemischen Reaktionen eingesetzt, z. B. Mitsunobu-Reaktion, Wittig-Reaktion usw. Hier macht man sich die Neigung des Phosphoratoms zu Nutze, gerne eine Bindung zum Sauerstoff einzugehen.
Phosphane werden auch im MOVPE Verfahren zur Herstellung phosphor-haltiger III-V Verbindungshalbleiter, z. B. GaP, GaAsP und InGaAsP für Leuchtdioden und Halbleiterlaser sowie ultra-schnelle Transistoren (HEMTs) verwendet.
Phosphorwasserstoffe werden als Rodentizid eingesetzt. Aluminiumphosphid und Calciumphosphid werden in Wühlmausgänge eingebracht und bilden mit Feuchtigkeit Phosphorwasserstoffe. Zinkphosphid wird als Fraßköder eingesetzt. Hier bildet sich im Magen Phosphorwasserstoff.
Derivate
Phosphanoxid (Phosphorylhydrid) O=PH3, das Oxid des Monophosphans, existiert nur in Form von Alkylderivaten OPR3, OPHR2 bzw. OPH2R. Ersetzt man im Phosphanoxid die drei Wasserstoffatome durch einwertige Reste (ausgenommen Hydroxylgruppen), so erhält man die Phosphorylverbindungen (siehe z. B. Phosphorylchlorid); ersetzt man sie nacheinander durch eine bis drei Hydroxylgruppen, so erhält man die Phosphin-, Phosphon- bzw. Phosphorsäure.
Siehe auch
Einzelnachweise
- ↑ M. Binnewies, M. Jäckel, H. Willner: Allgemeine und Anorganische Chemie. Spektrum Akademischer Verlag, 2003, ISBN 978-3827402080.
- ↑ Carey/Sundberg Organische Chemie , 2. korr. Nachdruck 2004.
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 525-30.
Quellen
- A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin u. New York 1995.
Wikimedia Foundation.