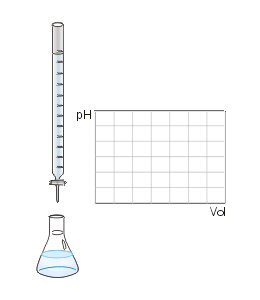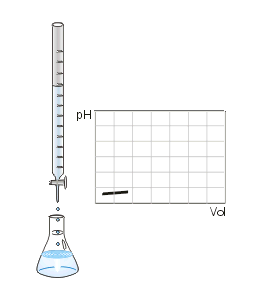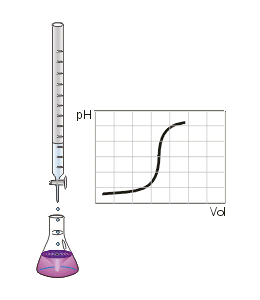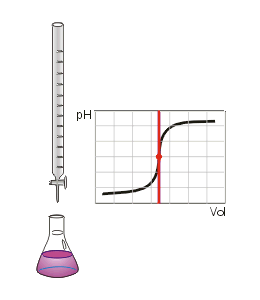
- Titrationskurve
-
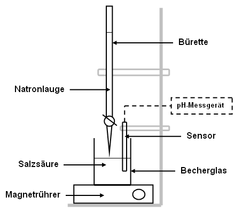
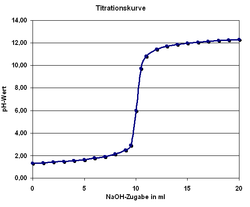
Die Titration (Titrimetrie, Volumetrie oder auch Maßanalyse) ist ein Verfahren der quantitativen Analyse in der Chemie. Mit einer Bürette wird zu einer Probelösung (Titrand) ein Reagenz bekannter Konzentration (Maßlösung, Titrator oder Titrant genannt) hinzugetropft, bis die Äquivalentstoffmengen gleich sind und der in der Probelösung enthaltene Indikator sich färbt ("Äquivalenzpunkt", sprunghafter Anstieg der Titrationskurve). An der Bürette wird das verbrauchte Volumen abgemessen und über stöchiometrische Umrechnungen die Menge oder die Konzentration des gesuchten Stoffes berechnet. Man unterscheidet die verschiedenen Titrationsarten unter drei Gesichtspunkten:
- nach den Reaktionstypen,
- nach der Methode der Erkennung des Endpunktes und
- nach den Titrationsarten (-techniken).
Inhaltsverzeichnis
Reaktionstypen
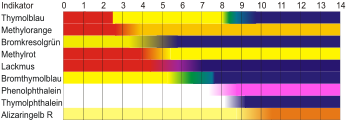
- Säure-Base-Titrationen (acidimetrische Titrationen) werden unter Zusatz von pH-Indikatoren wie Phenolphthalein durchgeführt
- Fällungsreaktion (z. B. Silberionen Ag+ mit Chloridionen Cl−) zeigen den Endpunkt manchmal durch Zusammenballen des milchigen Niederschlages an (Methoden nach Gay Lussac und Liebig), manchmal unterstützt durch die Zugabe eines Farbstoffes wie Eosin oder Fluorescein (Methode nach Fajans) oder durch Entstehen eines farbigen Produktes wie Eisenrhodanid (nach Volhard) oder Silberchromat ( Titration nach Mohr von K. F. Mohr).
- Komplexometrische Bestimmungen beruhen auf Komplexbildungsreaktionen; dabei können Farbstoffe zugesetzt werden oder die Farbänderung durch Bildung eines Komplexes photometrisch verfolgt werden.
- Redox-Titrationen
- Phasentransfer. Die 2-Phasen-Titration nach Epton dient zur Bestimmung von ionischen Tensiden in wässriger Lösung. Der Endpunkt ist der Farbumschlag einer Farbstoffmischung in der organisch-chlorierten Phase.
- Polyelektrolyttitration zur Bestimmung des kationischen Bedarfs. Als Titrant wird bei anionischen Suspensionen PolyDADMAC und bei kationischen KPVS verwendet.
Endpunktserkennung
- chemische Indikatoren (visuell)
- Farbumschlag von Indikatoren
- Niederschläge (z.B. Chloridbestimmung nach Mohr)
- physikalische Indikatoren (instrumentell)
- potentiometrische Titration beruht auf der sprunghaften Veränderung des elektrochemischen Potenzials
- pH-Wert-Messung mittels Glaselektrode
- Biamperometrie
- Konduktometrische Endpunktbestimmungen beruhen auf Messungen der elektrischen Leitfähigkeit.
Titrationsarten
Direkte und indirekte Titration
- Direkte Titration ...
Probelösung und Reagenzlösung werden unmittelbar miteinander umgesetzt- Direkte Titration im engeren Sinne ...
Die Probelösung wird vorgelegt und mit der Reagenzlösung direkt titriert - Inverse Titration ...
Eine abgemessene Menge an Reagenzlösung mit der Probelösung titriert
- Direkte Titration im engeren Sinne ...
- Indirekte Titration ...
Der zu untersuchende Stoff wird vor der Titration in einer chemischen Reaktion umgesetzt- Rücktitration ...
Die Probelösung wird mit einem bestimmten Volumen an Reagenzlösung vollständig umgesetzt. Anschließend wird der unverbrauchte Teil der Reagenzlösung durch eine Titration bestimmt. - Indirekte Titration im engeren Sinne ...
Der zu bestimmende Stoff wird in einer chemischen Reaktion zu einem genau festgelegten anderen Stoff umgesetzt, der dann titrimetrisch bestimmt wird - Substitutionstitration...
Ein zu bestimmender Stoff setzt ("substituiert") zunächst einen anderen Stoff (z.B. Ersatzkation) frei, der dann rücktitriert werden kann.
- Rücktitration ...
Spezielle Titrationen
- Aminzahl
- Bromzahl
- Chemischer Sauerstoffbedarf (CSB)
- Epton Titration
- Esterzahl (EZ; Menge von KOH in mg, erforderlich für die Verseifung von Estern in 1 g Fett)
- Halbtitration zur Bestimmung der Säurekonstante (pKS) einer Säure
- Iodzahl
- Karl-Fischer-Verfahren zur Bestimmung des Wassergehaltes
- Leitfähigkeitstitration
- Neutralisationszahl (NZ; Menge von KOH in mg, erforderlich für die Neutralisation aller freien Säuren in 1 g Fett)
- Ölzahl
- Peroxidzahl (POZ, Menge des als Peroxid gebundenen Sauerstoffs in mval O2 pro kg, der sich leicht als aktiver Sauerstoff abspalten lässt)
- Säurezahl (SZ; Menge von KOH in mg, erforderlich für die Neutralisation der freien organischen Säuren in 1 g Fett)
- Verseifungszahl
- wasserfreie Titration
Automatisierte Titration
Die verschiedenen Reaktionstypen und Titrationsarten können im automatisierten Laborreaktorsystem realisiert werden. Ein Laborautomatisierungssystem erfasst mit Hilfe einer geeigneten Sonde (pH-Glaselektrode, Leitfähigkeitssonde, Trübungssonde, Farbsonde...) den Zustand und steuert über eine Dosierpumpe die Zugabe der Reagenzlösung. Die zugegebene Menge wird meist durch automatische Messung der Gewichtsabnahme des Reagenz-Vorlagbehälters ermittelt.
Volumetrie ohne Titration
Eine besonders einfache Art der Volumetrie dient zur Volumenbestimmung eines Gases, indem dieses ein entsprechendes Flüssigkeitsvolumen verdrängt. Zu beachten ist, dass die Flüssigkeit passend zum zu bestimmenden Gas gewählt werden muss. Die Stickstoffbestimmung per Azotometer etwa nutzt dies, indem als Flüssigkeit eine Kaliumhydroxidlösung eingesetzt wird: diese absorbiert bei der Bestimmung ebenfalls entstehendes Kohlenstoffdioxid und Wasser und erlaubt es, das Stickstoffvolumen direkt an einer Maßskala der Azotometerbürette abzulesen.
Siehe auch
Literatur
- Jander, Jahr: Maßanalyse. 16. Auflage, de Gruyter, Berlin 2003, ISBN 3-11-017098-1.
- Leo Gros, Peter A. Bruttel, Marcus von Kloeden: Praktikum der Titration. Metrohm AG.
- Christian Haider: Elektroden in der Potentiometrie. Metrohm AG.
- Peter A. Bruttel: Nicht-wässrige Titrationen von Säuren und Basen mit potentiometrischer Endpunktbestimmung. Metrohm AG.
- Wolfgang Richter, Ursula Tinner: Practical aspects of modern Titration. Metrohm AG.
Weblinks
Wikimedia Foundation.