- Fluorescein
-
Strukturformel 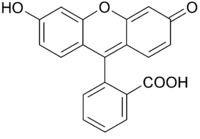
Allgemeines Name Fluorescein Andere Namen - Fluorescin
- Fluoreszin
- Resorcinphthalein
- 6-Hydroxy-9-(2-carboxyphenyl)- (3H)-xanthen-3-on
- 2-(6-Hydroxy-3-oxo- (3H)-xanthen-9-yl)- benzoesäure
- C.I. 45350
Summenformel C20H12O5 CAS-Nummer - 2321-07-5 (Säure)
- 518-47-8 (Natriumsalz)
PubChem 16850 ATC-Code Kurzbeschreibung rote Kristalle[1]
Eigenschaften Molare Masse 332,32 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit unlöslich in Wasser, leicht löslich in Ethanol, DMSO, Diethylether und Alkalien[1]
Sicherheitshinweise Bitte beachten Sie die eingeschränkte Gültigkeit der Gefahrstoffkennzeichnung bei Arzneimitteln GHS-Gefahrstoffkennzeichnung [2] 
Achtung
H- und P-Sätze H: 319 EUH: keine EUH-Sätze P: 305+351+338 [2] EU-Gefahrstoffkennzeichnung [3] 
Reizend (Xi) R- und S-Sätze R: 36 S: 26 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Fluorescein ist ein fluoreszierender Farbstoff aus der Gruppe der Xanthenfarbstoffe.
Inhaltsverzeichnis
Geschichte
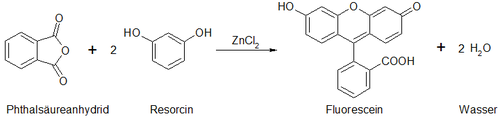
Fluorescein und andere Phthaleine wurden 1871 von Adolf von Baeyer entdeckt. Den alternativen Namen Resorcinphthalein verdankt der Stoff den Edukten, aus denen ihn Adolf von Baeyer synthetisierte. Er mischte Phthalsäureanhydrid (auch Phthalsäure ist verwendbar) mit Resorcin und fügte konzentrierte Schwefelsäure als wasserabspaltendes Mittel hinzu. Danach erhitzte er die Mischung zu einer dickflüssigen Schmelze und behandelte dann die abgekühlte Schmelze mit warmem Wasser und Ammoniak, anschließend brachte er den Ansatz in reichlich destilliertes Wasser.[4]
Darstellung
Fluorescein wird in der Regel durch Kondensation von einem Äquivalent Phthalsäureanhydrid und zwei Äquivalente Resorcin an einem Katalysator dargestellt. Als Katalysator eignet sich entweder konzentrierte Schwefelsäure oder wasserfreies Zinkchlorid.
Eigenschaften
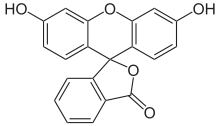
Fluorescein kommt in zwei verschiedenen Strukturen vor. Die stabilere ist dabei die offene Carbonsäure-Form, die im festen Zustand als rote Kristalle vorliegt. Daneben existiert noch die Spiro-Lacton-Form, die eine instabile, gelbe Verbindung bildet.[1]
- Absorptionsmaximum: 485 nm (pH 9)
- Extinktionskoeffizient: 93 000 l·cm−1·mol−1 (pH 9)
- Emissionsmaximum: 514 nm (pH 9)
- Quantenausbeute: 0,93 (50 µmol Fluorescein in 0,1 mol Natriumboratpuffer, pH 9,5)
- Fluoreszenzlebensdauer: 4,16 ns (Dianion in Natronlauge)
Verwendung
Fluorescein wird in der analytischen Chemie als Indikator verwendet. Darüber hinaus dient es zum Nachweis von Bromiden, zur Quellenfärbung und zur Färbung von Seifen und Badeextrakten/-salzen. Weiterhin ist Fluorescein ein Fluoreszenzfarbstoff, der bei Anregung mit blauem Licht (Absorptionsmaximum bei einer Wellenlänge von 496 nm, z. B. durch einen Argon-Ionen-Laser) grünes Licht (Wellenlänge ca. 520 bis 530 nm) abgibt. Verwandte Reaktivfarbstoffe wie z. B. Fluoresceinisothiocyanat (FITC) können mit verschiedenen Antikörpern (Immunglobulinen) gekoppelt werden und so für die Fluoreszenzmikroskopie oder Durchflusszytometrie eingesetzt werden. Damit können in Flüssigkeiten, Zellen oder Geweben dann spezifische Oberflächeneigenschaften (Antigene), z. B. auch von Krankheitserregern, nachgewiesen werden. Man bezeichnet diese Arbeitstechnik als direkte Immunfluoreszenz. Weiterhin wird Fluorescein als Färbemittel in der Augenheilkunde bei der Fluoresceinangiographie und der Applanationstonometrie verwendet.[5]
Fluorescein hat eine hohe Quantenausbeute von bis zu 93 %, seine Nützlichkeit zur Fluoreszenzmarkierung wird aber durch eine Reihe von Nachteilen eingeschränkt: Die Intensität der Fluoreszenz hängt vom pH-Wert ab und fällt stark unterhalb von pH 7 (pKs ≈ 6,4). Unter Beleuchtung geht außerdem die Fluoreszenz schnell zurück (starkes Photobleichen). Das Fluoreszenzmaximum ist nicht sehr scharf, die dazugehörige Absorptionsbande recht breit.
Analytik
Der klassische Nachweis beruht auf der Bromierung, durch die das rote Eosin (Tetrabromfluorescein) entsteht. Außerdem fallen verdünnte Lösungen von Fluorescein durch ihre gelbgrüne Fluoreszenzfarbe, auf der auch der Name beruht, auf.
Uranin
Das wasserlösliche Natriumsalz des Fluoresceins trägt den Namen Uranin (gleiche C.I.-Nummer 45350) und ist ein vielfältig verwendeter gelber, unter UV- und Tageslicht grün fluoreszierender Farbstoff.
Uranin besitzt in wässriger Lösung ein enormes Färbevermögen (in einer gefüllten weißen Badewanne führt bereits eine Uraninkonzentration von 0,1 mg/l zu einer sichtbaren Verfärbung).
So kann bei Schiffbrüchigen beziehungsweise nach Notwasserungen mit einer Menge von lediglich 500 g Uranin eine Meeresfläche von ca. 4000 m2 auffällig gefärbt und somit die Entdeckung durch Suchtrupps, gerade aus der Luft, erleichtert werden.[1]
Der Farbstoff wird weiterhin vielfältig eingesetzt, insbesondere zum Einfärben von Schaumbädern, Badezusätzen, Shampoos, Kosmetika und Frostschutzmitteln für Autokühler (um der Kühlflüssigkeit die Zugabe von Frostschutzmittel ansehen zu können). Uranin gilt als biologisch unbedenklich. Daher wird es von Hydrologen und Hydrogeologen als sogenannter Tracer zum Verfolgen von Grundwasserströmen und unterirdischen Flussläufen verwendet. 1877 hat man bei Immendingen 10 kg Uranin in die Donau eingebracht und 60 Stunden später in dem Flüsschen Aach eine deutliche Fluoreszenz bemerkt, wodurch die Donauversickerung aufgeklärt werden konnte.[6] Ferner nutzt man es auch bei Dichtigkeitsprüfung von Flachdächern und Tankanlagen.
Uranin wird auch zur Dekoration eingesetzt, zum Beispiel für Leuchtfarben in Diskotheken oder Szenenbildern (in Sciencefiction- oder Horrorfilmen: mit UV-Licht angestrahltes Uranin sieht „giftig-radioaktiv“ aus). Jährlich am 17. März, dem St. Patrick’s Day, wurde der Chicago River, der durch Chicago fließt, mit Uranin grün eingefärbt. Aufgrund der Intervention der EPA wurde das für Wasserorganismen toxische Fluorescein seit 2003 durch einen weniger giftigen Farbstoff ersetzt.[7]
Einzelnachweise
- ↑ a b c d e Hermann Römpp, Jürgen Falbe und Manfred Regitz: Römpp Lexikon Chemie. 9. Auflage, Georg Thieme Verlag, Stuttgart, 1992.
- ↑ a b Datenblatt Fluorescein (free acid) bei Sigma-Aldrich, abgerufen am 1. April 2011.
- ↑ Datenblatt Fluorescein bei AlfaAesar, abgerufen am 5. Januar 2010 (JavaScript erforderlich).
- ↑ Chemikalien-Lexikon, Eintrag Fluorescein.
- ↑ Robert L. Stamper, Marc F. Lieberman, Michael V. Drake: Becker-Shaffer's Diagnosis and Therapy of the Glaucomas. 8. Auflage, Elsevier Health Sciences, 2009, ISBN 978-0-323-02394-8, S. 47–50.
- ↑ A. Knop: Über die hydrographischen Beziehungen zwischen der Donau und der Aachquelle im badischen Oberlande. In: Neues Jahrb. Mineral. Geol. Palaeontol., (1878), S. 350–363.
- ↑ Other cities dye-ing to know what turns Chicago river green. Meldung in The Columbia Chronicle vom 20. März 2003.
Kategorien:- ATC-S01
- ATC-V04
- Reizender Stoff
- Triphenylmethanfarbstoff
- Fluoreszenzfarbstoff
- Benzolcarbonsäure
- Cyclohexadien
- Xanthen
- Phenol
- Keton
Wikimedia Foundation.