- Wilkinson-Katalysator
-
Strukturformel 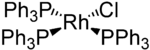
Allgemeines Name Wilkinson-Katalysator Andere Namen Chlorotris(triphenylphosphin)
rhodium(I) (IUPAC)Summenformel C54H45ClP3Rh CAS-Nummer 14694-95-2 Kurzbeschreibung dunkelroter, geruchloser, Feststoff[1]
Eigenschaften Molare Masse 925,24 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit schlecht in Wasser[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] keine GHS-Piktogramme H- und P-Sätze H: keine H-Sätze EUH: keine EUH-Sätze P: keine P-Sätze EU-Gefahrstoffkennzeichnung [1] keine Gefahrensymbole R- und S-Sätze R: keine R-Sätze S: 22-24/25 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Der Wilkinson-Katalysator ist ein in der organischen Chemie verwendeter Homogenkatalysator mit der Summenformel C54H45ClP3Rh. Es handelt sich hierbei um einen Rhodiumkomplex, der zur Hydrierung, Hydroformylierung, Hydrosilylierung und zur Isomerisierung von Allylgruppen zu Propenylgruppen Anwendung findet. Der Wilkinson-Katalysator ist nach seinem Entwickler, dem Nobelpreisträger Geoffrey Wilkinson, benannt.
Inhaltsverzeichnis
Struktur und Synthese
Beim Wilkinson-Katalysator handelt es sich um einen quadratisch-planaren Rhodium(I)-komplex, der einen Chloro- und drei Triphenylphosphin-Liganden (PPh3) trägt. Es handelt sich um einen 16-Valenzelektronenkomplex. Er lässt sich durch Substitution von Triphenylphosphan an Rhodiumtrichlorid in siedendem Ethanol synthetisieren. Ethanol wirkt hierbei sowohl als Lösungsmittel als auch als Reduktionsmittel (Reduktion von Rh(III) zu (Rh(I)).[3]

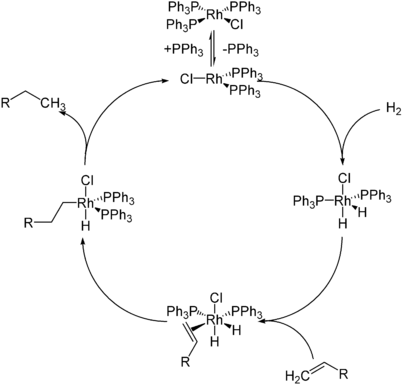
Katalysezyklus
Die Wilkinson-Hydrierung wird zur Hydrierung von Alkenen mit Wasserstoff genutzt. Entscheidend ist hierbei die Labilität der gebundenen Phosphinliganden, durch deren Abspaltung freie Koordinationsstellen geschaffen werden. Im ersten Schritt spaltet sich ein Phosphinligand vom Katalysator ab. Dann addiert Wasserstoff oxidativ an die zuvor gebildete trigonal-planare 14-Valenzelektronenspezies. Hierbei bildet sich ein trigonal-bipyramidale Komplex. Die Oxidationsstufe ändert sich von I auf III. Das eingesetzte Alken koordiniert dann zunächst side-on am Metall. Anschließend findet die Insertion des Alkens unter Hydrierung statt. Es bildet sich wieder ein trigonal-bipyramidaler Komplex, der nun einen end-on-gebundenen Alkylrest trägt. Die Hydrierung durch den zweiten gebundenen Wasserstoff führt letztlich zur Abspaltung (reduktive Eliminierung) des Alkans unter Rückbildung der Katalysatorspezies.[4]
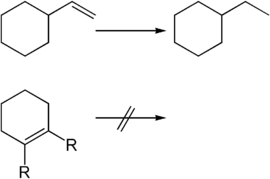
Durch den Wilkinson-Katalysator können selektiv endständige Doppelbindungen hydriert werden. Die Reaktion läuft an diesen so viel schneller ab, dass eine weitere im Molekül vorhandene nicht-endständige Doppelbindung nicht angegriffen wird. Bei sterisch anspruchsvollen Substituenten an der Doppelbindung sowie bei vierfach substituierten Doppelbindungen findet meist überhaupt keine Hydrierung statt.
Asymmetrische Hydrierungen
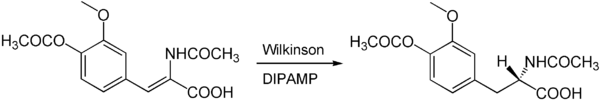
Der Wilkinson-Katalysator kann auch zur asymmetrischen Synthese chiraler Produkte eingesetzt werden. Hierzu werden anstelle der achiralen Triphenylphosphinliganden chirale Phosphine wie beispielsweise DIPAMP oder DIOP verwendet. So kann beispielsweise das Chiralitätszentrum des medizinisch wichtigen Aminosäure L-DOPA über eine asymmetrische Wilkinson-Hydrierung mit DIPAMP als chiralem Ligand aufgebaut werden.[5]
Weblinks
 Commons: Wilkinson-Katalysator – Sammlung von Bildern, Videos und Audiodateien
Commons: Wilkinson-Katalysator – Sammlung von Bildern, Videos und AudiodateienEinzelnachweise
- ↑ a b c d Eintrag zu CAS-Nr. 14694-95-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2.12.2007 (JavaScript erforderlich)
- ↑ Datenblatt Tris(triphenylphosphine)rhodium(I) chloride bei Sigma-Aldrich, abgerufen am 29. Mai 2011.
- ↑ J. A. Osborn, F.H. Jardine,J. F. Young, G. Wilkinson, Journal of the Chemical Society A. 1966, S. 1711-1732
- ↑ Beyer/Walter: Lehrbuch der Organischen Chemie. Hirzel Verlag, 23. Auflage. 1998, S. 406f.
- ↑ Christen und Fritz Vögtle: Organische Chemie Bd. 2, Otto Salle Verlag, 2. Auflage, 1996, S. 411.
Kategorien:- Chlorverbindung
- Katalysator
- Komplex
- Phenylphosphan
- Rhodiumverbindung
Wikimedia Foundation.