- Bromessigsäure
-
Strukturformel 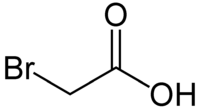
Allgemeines Name Bromessigsäure Andere Namen - Bromethansäure
- Monobromessigsäure
Summenformel C2H3BrO2 CAS-Nummer 79-08-3 PubChem 6227 Kurzbeschreibung weißer bis gelblicher Feststoff mit stechendem Geruch[1]
Eigenschaften Molare Masse 138,95 g·mol−1 Aggregatzustand fest
Dichte 1,93 g·cm−3[1]
Schmelzpunkt Siedepunkt 208 °C[1]
Dampfdruck pKs-Wert 2,87 (25 °C)
Löslichkeit löslich in Wasser (93,8 g·l−1)[1]
Sicherheitshinweise GHS-Gefahrstoffkennzeichnung [2] 


Gefahr
H- und P-Sätze H: 331-311-301-314-317-400 EUH: keine EUH-Sätze P: 261-273-280-301+310-305+351+338-310 [3] EU-Gefahrstoffkennzeichnung aus RL 67/548/EWG, Anh. I [4] 


Giftig Ätzend Umwelt-
gefährlich(T) (C) (N) R- und S-Sätze R: 23/24/25-35-43-50 S: (1/2)-26-36/37/39-45-61 LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Bromessigsäure (auch: Monobromessigsäure) ist ein Derivat der Essigsäure, bei welcher ein Wasserstoffatom der Methylgruppe durch ein Bromatom ersetzt ist. Ihre Salze werden als (Mono-)Bromacetate bezeichnet.
Inhaltsverzeichnis
Darstellung
Die Darstellung erfolgt durch Umsetzung von Chloressigsäure mit Kaliumbromid (nukleophile Substitution):
Eigenschaften
Bromessigsäure bildet farblose Kristalle mit stechendem Geruch, die zwischen 46 und 49 °C schmelzen und sich leicht in Wasser, Ethanol, Diethylether und anderen organischen Lösungsmitteln lösen. Die wässrige Lösung reagiert stark sauer, deutlich stärker sauer als Essigsäure. Der Grund dafür ist die Stabilisierung des Anions durch das recht elektronegative Bromatom: Es wirkt elektronenziehend und verteilt (delokalisiert) die negative Ladung des Anions über das gesamte Molekül. Das Anion bildet sich daher leichter als das entsprechende Anion der Essigsäure. In wässriger Lösung bildet die Bromessigsäure mit Wasser unter Bildung von Oxonium-Ionen und Bromacetat-Anionen.
Verwendung
Bromessigsäure ist Ausgangsstoff für verschiedene Synthesen, beispielsweise für Pflanzenschutzmittel oder Arzneimittel.
Direkte Anwendung fand Bromessigsäure als Konservierungsmittel für Lebensmittel. Diese Anwendung ist allerdings mittlerweile in den meisten Staaten verboten. Bromessigsäure ist stark alkylierend und hat eine hemmende Wirkung auf Enzyme mit SH-, OH- oder NH2-Gruppen im aktiven Zentrum. Sie kam früher hauptsächlich in süßen französischen Weinen vor.[5] In den 1980er Jahren gab es in der Bundesrepublik Deutschland einen Skandal wegen der verbotenen Verwendung von Bromessigsäure als Konservierungsmittel in Bier.[6]Flüchtige Ester der Bromessigsäure werden als Tränengas verwendet. Sie wirken reizend auf das Atmungssystem und die Augen und können dafür schädlich sein. Bei größerer Konzentration wirken sie ätzend und können dauernde Schäden an den Augen verursachen. Sie sollten nicht von Kindern verwendet werden und deshalb als Scherzartikel verboten werden.[7]
Sicherheitshinweise
Bromessigsäure und ihre Lösungen wirken stark ätzend und sind giftig.
Einzelnachweise
- ↑ a b c d e f g h Datenblatt Bromessigsäure bei Merck, abgerufen am 22. Januar 2011.
- ↑ Eintrag zu CAS-Nr. 79-08-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. März 2011 (JavaScript erforderlich)
- ↑ Datenblatt Bromessigsäure bei Sigma-Aldrich, abgerufen am 14. März 2011.
- ↑ Eintrag zu CAS-Nr. 79-08-3 im European chemical Substances Information System ESIS
- ↑ Lehrbuch Lebensmittelchemie und Ernährung, S. 590, Springer 21 April 2008, ISBN 978-3-211-48649-8 (Zugriff am 31 August 2011)
- ↑ Birgit Speckle: Streit ums Bier in Bayern: Wertvorstellungen um Reinheit, Gemeinschaft und Tradition, S. 120, Waxmann Verlag 2001, ISBN 978-3-89325-919-9 (Zugriff am 31 August 2011)
- ↑ Richtlinie 83/264/EWG des Rates vom 16. Mai 1983.
Kategorien:- Giftiger Stoff
- Sensibilisierender Stoff
- Ätzender Stoff
- Umweltgefährlicher Stoff
- Bromalkan
- Carbonsäure
Wikimedia Foundation.


