- Buckminster-Fulleren
-
Als Fullerene (Einzahl: Fulleren) werden sphärische Moleküle aus Kohlenstoffatomen (mit hoher Symmetrie, z. B. Ih-Symmetrie für C60) bezeichnet, welche die dritte Element-Modifikation des Kohlenstoffs (neben Diamant und Graphit) darstellen.
Inhaltsverzeichnis
Geschichte
Die erste Veröffentlichung zu Fullerenen erfolgte bereits im Jahr 1970 von dem japanischen Chemiker Eiji Oosawa, der ihre Existenz theoretisch vorhersagte und berechnete.[1] [2] [3] [4] Diese und folgende seiner Publikationen veröffentlichte er in japanischer Sprache, weswegen erst die 15 Jahre später am 14. November 1985 in der Zeitschrift Nature[5] erschienene Publikation der Forscher Robert F. Curl jr. (USA), Sir Harold W. Kroto (England) und Richard E. Smalley (USA) weltweite Aufmerksamkeit erlangte. Diese erhielten dafür im Jahr 1996 den Nobelpreis für Chemie, während Oosawa unberücksichtigt blieb.
Name
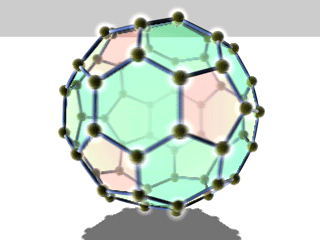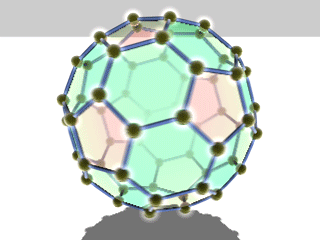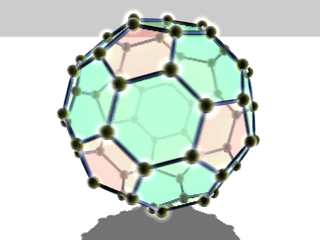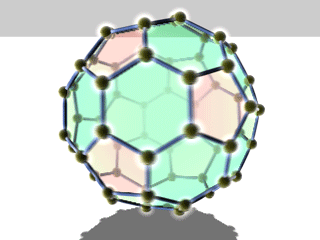
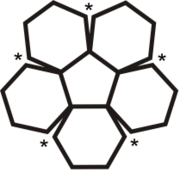
Die bekanntesten und stabilsten Vertreter der Fullerene haben die Summenformeln C60, C70, C76, C80, C82, C84, C86, C90 und C94. Das mit Abstand am besten erforschte Fulleren ist C60, das zu Ehren des Architekten Richard Buckminster Fuller Buckminster-Fulleren (oder in englisch auch Bucky Ball) genannt wurde, da es den von ihm konstruierten geodätischen Kuppeln ähnelt. Es besteht aus 12 Fünfecken und 20 Sechsecken, die zusammen ein Abgestumpftes Ikosaeder (Archimedischer Körper) bilden. Da ein Fußball die gleiche Struktur hat, wird es auch Fußballmolekül (Footballen) genannt.
Herstellung
Graphit wird unter reduziertem Druck in Schutzgasatmosphäre (Argon) mit einer Widerstandsheizung oder im Lichtbogen in einer Helium-Atmosphäre verdampft. Möglich ist auch die Herstellung unter ausschließlicher Verwendung rationaler Synthesen, wobei hier im letzten Schritt eine Flash-Vakuum-Pyrolyse erfolgt.[6] Die Ausbeute bei diesem Verfahren liegt hierbei bei etwa 1 %. Dieses Verfahren ist damit deutlich teurer als die Herstellung im Lichtbogen.
Man kann auch eine speziell präparierte Rußprobe mit Toluol im Soxhlet-Extraktor bei 110 Grad Celsius extrahieren. Dabei entstehen Kohlenstoffcluster wie C2, C4 und C6, die bei Abkühlung wieder zu größeren Einheiten zusammentreten. Dabei ist C60 die am häufigsten auftretende Form, daneben findet man auch C70 und höhere Fullerene. Im Ruß, der nach Abkühlung zurückbleibt, werden die Fullerene, aber auch Kohlenstoff-Nanoröhren gefunden. Eine erste Abtrennung erfolgt mit Benzol, in dem sich Fullerene gut lösen, der restliche Ruß jedoch schlecht. Durch Chromatographie (z. B. an Aktivkohle und/oder Kieselgel) können die Fullerene aufgetrennt werden.
Die Fullerene C60 und C70 kommen natürlich in Shungit und Fulgurit vor.
Eigenschaften
Die Fullerene sind braun-schwarze Pulver von metallischem Glanz. Sie lösen sich in manchen organischen Lösungsmitteln (z. B. Toluol) unter charakteristischer Färbung. Fullerene lassen sich bei ca. 400 °C sublimieren.
Verschiedene Möglichkeiten zur Verwendung als Katalysator, Schmiermittel, zur Herstellung künstlicher Diamanten, in der Medizin, als Halbleiter und Supraleiter sind Gegenstand der Forschung.
Einen Einsatz findet das C60-Molekül zum Beispiel in Anti-Aging-Cremes. Aufgrund seiner elektronischen Eigenschaften kann es extrem viele Radikale aufnehmen und binden (Radikalfänger). Diese sollen für den Alterungsprozess der Haut mitverantwortlich sein. Die Wirkung von Fullerenen ist jedoch nicht wissenschaftlich belegt.
Nomenklatur
Lange Zeit weigerte sich die für verbindliche Empfehlungen zur Nomenklatur chemischer Verbindungen zuständige IUPAC, den Trivialnamen Fulleren anzuerkennen. Erst im Jahre 2002 änderte sie ihre Meinung und empfiehlt seitdem die Verwendung von Fulleran, Fulleren und Fulleroid. Dies bedeutet eine erhebliche Erleichterung, denn bis dahin wäre der korrekte, d. h. IUPAC-konforme Name z. B. des [60]Fullerens (C60) folgender gewesen:
[29.29.0.0.2,14.03,12.04,59.05,10.06,58.07,55.08,53.09,21.011,20.013,18.015,30.016,28.017,25.019,24.022,52.023.50.026,49.027,47.029,45.032,44.033,60.034,57.035,43.036,56.037,41.038,54.039,51.040,48.042,46]hexaconta-1,3,5(10),6,8,11,13(18),14,16,19,21,23,25,27,29(45),30,32(44),33,35(43),36,38(54),39(51),40(48),41,46,49,52,55,57,58-triaconten
Struktur und Stabilität
Viele Fullerene bestehen aus 12 Fünfecken, die von einer unterschiedlichen Anzahl an Sechsecken umgeben sind. Durch die Unmöglichkeit, eine Ebene mit regelmäßigen Fünfecken vollständig zu bedecken, ergibt sich die sphärische Wölbung (siehe Bild rechts).
C60 hat Ikosaeder-Symmetrie. Die Fullerene mit mehr als 60 C-Atomen besitzen i. A. geringere Symmetrie, C70 etwa ist annähernd ein Ellipsoid mit D5h-Symmetrie.
Die Stabilität eines Fullerens ist dann am größten,
- wenn die Fünfecke nicht aneinander grenzen, sondern nur von Sechsecken umgeben sind (Fünfeckregel, engl.: isolated pentagon rule – IPR),
- wenn der aromatische Charakter ausgeprägt ist (siehe Aromatizität, wobei hier allerdings die sog. sphärische Aromatizität[7] betrachtet werden muss), und
- wenn es eine magische Zahl (60, 70, 76 usw.) an C-Atomen besitzt
Fullerene sind eng verwandt mit Graphen, einer Modifikationen des Kohlenstoffs, bei der die C-Atome eine monomolekulare Schicht mit hexagonaler Struktur bilden.
Reaktionen von C60
Fullerene bieten keine Ansatzpunkte für chemische Modifikationen. Durch Additionsreaktionen an die Doppelbindungen erhält man exohedrale Addukte. Das Ersetzen von Kohlenstoffatomen aus der Käfighülle durch z. B. Stickstoffatome zum C59N bezeichnet man als substitutionelles Doping. Schließlich bieten derartige Käfigstrukturen noch die Möglichkeit, Atome oder Verbindungen in den Hohlraum einzubringen. Verbindungen dieser Art bezeichnet man als endohedrale Komplexe. Zur Kennzeichnung endohedraler Komplexe hat sich in der Literatur die Schreibweise X@Cn durchgesetzt, bei der sich ein Atom oder Cluster X im Inneren eines Fullerenkäfig aus n-Kohlenstoffatomen befindet.
C60 besitzt einen Hohlraum mit einem Durchmesser von 700 pm, in den Metall- und Nichtmetallatome eingelagert werden können. Ein Beispiel ist die Einlagerungsverbindung des Heliums, die mit der Notation He@C60 korrekt bezeichnet wird. He@C60 entsteht, wenn Graphit in einer Helium-Atmosphäre verdampft wird.
Weiterhin kann C60 die für Aromaten aber auch Alkene typischen Reaktionen wie Hydrierung, Halogenierung, Ozonolyse und Birch-Reduktion eingehen. Jedoch findet in der Regel keine vollständige Umsetzung aller Doppelbindungen statt; nur mit Fluor kann die Zusammensetzung C60F60 erreicht werden.
Weitere interessante Verbindungen sind die ionischen Alkalimetall-Fulleride: C60 kann mit Natrium und Kalium reduziert werden. Dabei entstehen Verbindungen der Zusammensetzung MC60, M2C60 und M3C60 (M = Na, K). KC60 kristallisiert in der Natriumchlorid-Struktur. In K3C60 liegt das C603−-Anion vor und bildet eine kubisch-dichteste Kugelpackung, wobei die K+-Kationen alle vorhanden Tetraeder- und Oktaeder-Lücken in der Kristallstruktur besetzen. K3C60 ist ein Supraleiter.
In der Gruppe von Anton Zeilinger an der Universität Wien (siehe Weblink) wurde die Interferenz von C60-Molekülen am Gitter beobachtet.[8] Damit wurden die von Louis de Broglie postulierten Materiewellen auch für relativ makroskopische Objekte gezeigt.
In der Arbeitsgruppe von Jochen Mattay an der Universität Bielefeld wurden weitreichende Untersuchungen über die Funktionalisierung der Fullere zu Aza-Heterofullerenen gemacht.
Weblinks
- Wave-particle duality of C60
- ChemLin (umfangreiche Linkliste)
- Faltanleitung für ein Fulleren aus Papier
- Chemie an Fullerenen
- Vortrag über Aromatizität an der Universität Heidelberg
Literatur
- Joachim Dettmann: Fullerene – Die Buckyballs erobern die Chemie. Birkhäuser Verlag, Basel/Boston/Berlin, 1994. ISBN 3-7643-2947-5
- Andreas Hirsch, Michael Brettreich: Fullerenes – Chemistry and Reactions, Wiley-VCH, Weinheim, 2005. ISBN 3-527-30820-2
Einzelnachweise
- ↑ Eiji Oosawa: 大澤映二 (Superaromaticity). In: 「化学」 (Kagaku). 25, 1970, S. 854–863 (Japanisch).
- ↑ Z. Yoshida, E. Osawa: Aromaticity. In: Kagaku Dojin. 22, 1971, S. 174–178 (Japanisch).
- ↑ István Hargittai: The Road to Stockholm: Nobel Prizes, Science, and Scientists Oxford University Press, 2002, ISBN 0-19-850912-X, S. 87
- ↑ D. B. Boyd, Z. Slanina: Introduction and foreword to the special issue commemorating the thirtieth anniversary of Eiji Osawas C60 paper. In: Journal of Molecular Graphics and Modelling. 19, Nr. 2, 2001, S. 181–184 (doi:10.1016/S1093-3263(00)00106-6).
- ↑ H. W. Kroto, J. R. Heath, S. C. O’Brien, R. F. Curl, R. E. Smalley: C60: Buckminsterfullerene. In: Nature 318, 1985, S. 162–163. doi:10.1038/318162a0
- ↑ Anke Krüger: Neue Kohlenstoffmaterialien. Vieweg+Teubner, 2007, ISBN 978-3-519-00510-0.
- ↑ Andreas Hirsch, Zhongfang Chen, Haijun Jiao: Sphärische Aromatizität in Ih-symmetrischen Fullerenen: die 2(N+1)2-Regel. In: Angew. Chem.. 112, 2000, S. 4079–4081 (doi:<4079::AID-ANGE4079>3.0.CO;2-H 10.1002/1521-3757(20001103)112:21<4079::AID-ANGE4079>3.0.CO;2-H) (PDF).
- ↑ Markus Arndt, Olaf Nairz, Julian Voss-Andreae, Claudia Keller, Gerbrand van der Zouw, Anton Zeilinger: Wave-particle duality of C60 molecules. In: Nature. 401, Nr. 6754, 1999, S. 680–682 (doi:10.1038/44348) ([1]).
Wikimedia Foundation.