- Tribrombenzole
-
Tribrombenzole Name 1,2,3-Tribrombenzol 1,2,4-Tribrombenzol 1,3,5-Tribrombenzol Andere Namen vic.-Tribrombenzol asym.-Tribrombenzol sym.-Tribrombenzol Strukturformel 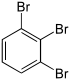
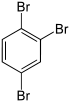
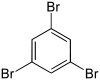
CAS-Nummer 608-21-9 615-54-3 626-39-1 PubChem 11842 12002 12279 Summenformel C6H3Br3 Molare Masse 314,80 g·mol−1 Aggregatzustand fest Schmelzpunkt 87 °C[1] 44,5 °C[2] 122,8 °C[2] Siedepunkt 275 °C[2] 271 °C[2] Löslichkeit unlöslich in Wasser GHS-
Einstufung
[3][4]keine Einstufung verfügbar
Achtung

keine GHS-Piktogramme H- und P-Sätze siehe oben 315-319-335-410 413 siehe oben keine EUH-Sätze keine EUH-Sätze siehe oben 261-273-305+351+338-501 keine P-Sätze Gefahrstoff-
kennzeichnungkeine Einstufung verfügbar 
Reizend (Xi) keine Gefahrensymbole R-Sätze siehe oben 36/37/38[3] keine R-Sätze[4] S-Sätze siehe oben 26-37/39[3] 22-24/25[4] Die Tribrombenzole bilden in der Chemie eine Stoffgruppe, deren Struktur aus einem Benzolring mit drei Bromatomen (–Br) als Substituenten besteht. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere mit der Summenformel C6H3Br3.
Inhaltsverzeichnis
Darstellung
1,2,3-Tribrombenzol
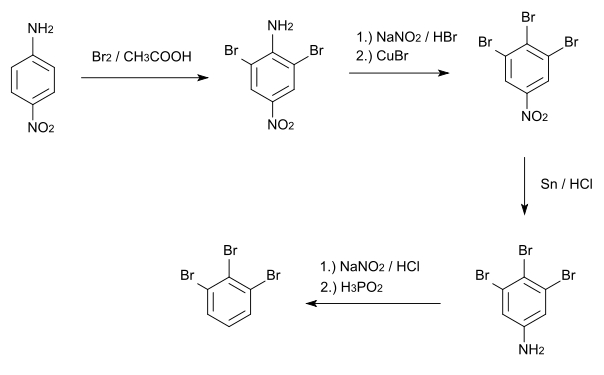
1,2,3-Tribrombenzol wird aus p-Nitroanilin hergestellt, das zunächst mit elementarem Brom und Eisessig an den Positionen 2 und 6 bromiert wird. Dann wird mit einer Sandmeyer-Reaktion die Aminogruppe durch ein Bromatom ersetzt. Das entstandene 3,4,5-Tribromnitrobenzol wird anschließend mit Zinn und Salzsäure zum 3,4,5-Tribromanilin reduziert. Schließlich wird die Aminogruppe nach einer Diazotierung entfernt.[5]
1,2,4-Tribrombenzol
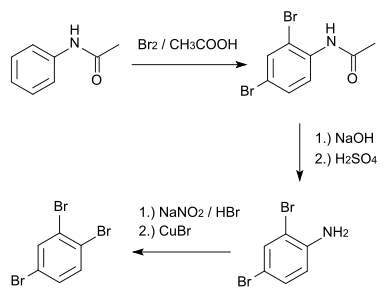
Der Ausgangsstoff für die Darstellung von 1,2,4-Tribrombenzol ist Acetanilid, das zunächst mit gasförmigem Brom, das in eine wässrige Suspension eingeleitet wird, an den Positionen 2 und 4 bromiert wird. Durch Behandeln mit Natronlauge und anschließendem Kochen mit Schwefelsäure entsteht 2,4-Dibromanilin. Durch eine Sandmeyer-Reaktion kann die Aminogruppe anschließend durch ein Bromatom ersetzt werden.[6]
1,3,5-Tribrombenzol
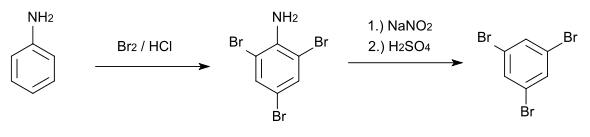
1,3,5-Tribrombenzol wird aus Anilin hergestellt, das mit elementarem Brom in Salzsäure zum 2,4,6-Tribromanilin umgewandelt wird.[7] Diese Verbindung wird anschließend diazotiert und mit Schwefelsäure in Ethanol zum gewünschten Produkt umgesetzt.[7][8]
Eigenschaften
1,2,4-Tribrombenzol
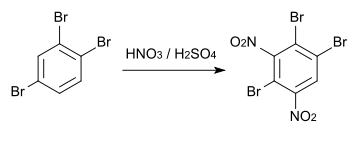
1,2,4-Tribrombenzol kristallisiert in Nadeln mit aromatischem Geruch. Es ist in Ethanol und Diethylether löslich, jedoch nur wenig löslich in Benzol.[9] In Wasser ist es praktisch unlöslich (0,0101 g/l).[10] Der Flammpunkt von 1,2,4-Tribrombenzol liegt über 110 °C.[11] Nitrierung von 1,2,4-Tribrombenzol mit Salpetersäure und Schwefelsäure führt zu 1,2,4-Tribrom-3,5-dinitrobenzol.[6]
1,3,5-Tribrombenzol
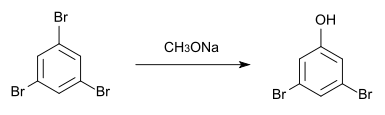
1,3,5-Tribrombenzol kristallisiert im orthorhombischen Kristallsystem mit der Raumgruppe P212121 und den Gitterparametern a = 1424,4 pm, b = 1357,7 pm und c = 408,4 pm. In der Elementarzelle befinden sich 4 Formeleinheiten. Es ist isomorph zu 1,3,5-Trichlorbenzol.[12] Es ist wenig löslich in heißem Ethanol. Mit Natriummethanolat reagiert es bei 130 °C zu 3,5-Dibromphenol.[9]
Einzelnachweise
- ↑ http://www.chem.ubc.ca/courseware/235/EXP_6-List_of_Unknowns.html
- ↑ a b c d CRC Handbook of Chemistry and Physics, 90. Auflage, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 3, Physical Constants of Organic Compounds, p. 3-488.
- ↑ a b c Datenblatt 1,2,4-Tribromobenzene bei Sigma-Aldrich, abgerufen am 11. Mai 2011.
- ↑ a b c Datenblatt 1,3,5-Tribromobenzene bei Sigma-Aldrich, abgerufen am 11. Mai 2011.
- ↑ C. L. Jackson, F. B. Gallivan: "On the 3,4,5-Tribromaniline and some derivatives of unsymmetrical tribrombenzol", in: American Chemical Journal, 1898, 20, S. 179–189; Volltext.
- ↑ a b C. L. Jackson, F. B. Gallivan: "Some derivatives of unsymmetrical tribrombenzol", in: American Chemical Journal, 1896, 18, S. 238–252; Volltext.
- ↑ a b G. H. Coleman, W. F. Talbot: sym.-Tribromobenzene. In: Organic Syntheses. Coll. Vol. 2, p. 592 (1943); Vol. 13, p. 96 (1933); PDF.
- ↑ Vorsuchsvorschrift: 1,3,5-Tribrombenzol der Sammlung Integriertes Organisch-chemisches Praktikum, abgerufen am 30. Oktober 2011.
- ↑ a b Heilbron: "Dictionary of organic compounds, Volume Four", 1953, S. 545; Volltext.
- ↑ IUPAC-NIST Solubility Database
- ↑ MSDS bei www.chemcas.com
- ↑ A. Belaaraj, Nguyen-ba-Chanh, Y. Haget, M. A. Cuevas-Diarte: "Crystal data for 1,3,5-trichlorobenzene and 1,3,5-tribromobenzene at 293 K", in: J. Appl. Cryst., 1984, 17, S. 211; doi:10.1107/S002188988401133X.
Kategorien:- Reizender Stoff
- Stoffgruppe
- Bromaromat
Wikimedia Foundation.