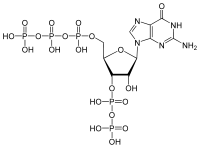
- Guanosin-3′,5′-bispyrophosphat
-
Strukturformel 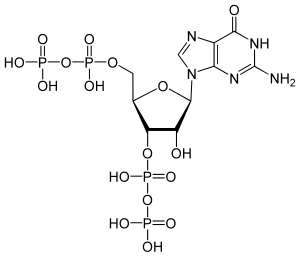
Allgemeines Name Guanosin-3′,5′-bispyrophosphat Andere Namen - ppGpp
- Guanosin-5′,3′-tetraphosphat
Summenformel C10H17N5O17P4 CAS-Nummer 32452-17-8 PubChem 766 DrugBank DB04022 Eigenschaften Molare Masse 603,16 g·mol−1 Aggregatzustand fest
Sicherheitshinweise EU-Gefahrstoffkennzeichnung [1] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Guanosin-3′,5′-bispyrophosphat, oder ppGpp ist das Signalmolekül einer bakteriellen Stressantwort, der sogenannten stringent response. Es ist ein Derivat des Guanosindiphosphats, das am 3'-Atom der Ribose eine zusätzliche Pyrophosphatgruppe trägt.
ppGpp wurde zuerst in Escherichia coli entdeckt. In E. coli ist ppGpp ein Indikator für Nährstoffmangel.
Inhaltsverzeichnis
ppGpp Kreislauf
In E. coli wird das Vorläufermolekül pppGpp von zwei ppGpp-Synthetasen aus ATP und GTP hergestellt, RelA und SpoT. RelA kann zudem direkt ppGpp herstellen. Eine 5'-Phosphohydrolase[2] spaltet den Phosphatrest von pppGpp ab. RelA ist an die Ribosomen gebunden, fungiert als Sensor für unbeladene tRNAs und synthetisiert pppGpp bei Aminosäuremangel.[3] SpoT ist ein cytosolisches Protein[4] und synthetisiert pppGpp bei Glukosemangel.[5] Im Gegensatz zu RelA baut SpoT ppGpp zu Pyrophosphat und GDP ab.[6] Die DNA-Sequenzen der relA- und spoT-Gene von E. coli sind ähnlich, somit handelt es sich um paraloge Gene. Im N-terminus finden sich jedoch Unterschiede, die sogenannte HD-Domäne; die in Hydrolasen vorkommt, ist im relA-Gen mutiert.[7] Deswegen kann RelA ppGpp nicht abbauen.
Funktion
ppGpp bindet an die RNA-Polymerase[8] und hat einen tiefgreifenden Effekt auf die Transkription verschiedener Gene. Es verringert die Transkriptionsrate an rRNA-Genen und induziert die Transkription von Genen, die an der Aminosäurebiosynthese beteiligt sind. ppGpp ist ein globaler Regulator der Genexpression in E. coli.[9]
ppGpp in anderen Bakterien
Im Gegensatz zu E. coli und vielen anderen Bakterien verfügen manche Bakterien, z. B. Bacillus subtilis und viele andere grampositive Bakterien, nur über eine einziges ppGpp metabolisierendes Enzym, das ppGpp herstellt und abbaut.[10] In vielen pathogenen Bakterien spielt ppGpp eine wichtige Rolle als globaler Regulator der Genexpression. Bei diesen Bakterien ist ppGpp sogar als Virulenzfaktor identifiziert:
- Mycobacterium tuberculosis[11]
- Legionella pneumophila[12]
- Pseudomonas aeruginosa[13]
- Borrelia burgdorferi[14]
- Vibrio cholerae[15]
- Listeria monocytogenes[16]
- verschiedene Brucella-Arten.[17][18]
Somit stellt die ppGpp-Synthese einen bisher nicht identifizierten, möglichen Angriffsort für neuartige Antibiotika dar. In Streptomyces coelicolor und anderen Streptomyceten ist ppGpp für Antibiotikabiosynthese notwendig.[19]
Bei Rhizobien ist ppGpp essentiell für die Symbiose zwischen Bakterium und Pflanze und für die Stickstofffixierung.[20][21] Bei Archaeen wurde ppGpp bisher nicht nachgewiesen.ppGpp in Pflanzen
ppGpp kommt auch in Pflanzen vor. Es wird in den Chloroplasten synthetisiert und spielt ebenfalls eine wichtige Rolle bei der Adaptation an veränderte Umweltbedingungen.[22]
Literatur
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Keasling, JD. et al. (1993): Guanosine pentaphosphate phosphohydrolase of Escherichia coli is a long-chain exopolyphosphatase. In: PNAS 90(15), 7029–7033, PMID 8394006; PMC 47069.
- ↑ Haseltine., W. und Block, R. (1973): Synthesis of guanosine tetra- and pentaphosphate requires the presence of a codon-specific, uncharged transfer ribonucleic acid in the acceptor site of ribosomes. In: PNAS 70(5), 1564–1568, PMID 4576025; PMC 433543.
- ↑ Gentry, DR. und Cashel, M. (1995): Subcellular localization of the Escherichia coli SpoT protein. In: J. Bacteriol. 177(13), 3890–3893, PMID 7601859; PMC 177113.
- ↑ Hernandez, VJ. und Bremer, H. (1991): Escherichia coli ppGpp-synthetase II activity requires spoT. In: J. Biol. Chem. 266(9), 5991–5999, PMID 2005135; PDF (freier Volltextzugriff, engl.)
- ↑ Murray, KD. und Bremer, H. (1996): Control of spoT-dependent ppGpp synthesis and degradation in Escherichia coli. In: J. Mol. Biol. 259(1), 41–57, PMID 8648647; doi:10.1006/jmbi.1996.0300
- ↑ Aravind, L. und Koonin, EV. (1998): The HD domain defines a new superfamily of metal-dependent phosphohydrolases. In: Trends Biochem Sci. 23(12), 469–472, PMID 9868367; doi:10.1016/S0968-0004(98)01293-6
- ↑ Artsimovitch, I. et al. (2004): Structural basis for transcription regulation by alarmone ppGpp. In: Cell 117(3), 299–310, PMID 15109491; PDF (freier Volltextzugriff, engl.)
- ↑ Magnusson, LU. et al. (2005): ppGpp: a global regulator in Escherichia coli. In: Trends Microbiol. 13(5), 236–242, PMID 15866041; doi:10.1016/j.tim.2005.03.008
- ↑ Mittenhuber, G. (2001): Comparative genomics and evolution of genes encoding bacterial (p)ppGpp synthetases/hydrolases (the Rel, RelA and SpoT proteins). In: J. Mol. Microbiol. Biotechnol. 3(4), 585–600, PMID 11545276
- ↑ Warner, DF. und Mizrahi, V. (2006): Tuberculosis chemotherapy: the influence of bacillary stress and damage response pathways on drug efficacy. In: Clin. Microbiol. Rev. 19(3), 558–570, PMID 16847086; PDF (freier Volltextzugriff, engl.)
- ↑ Molofsky, AB. und Swanson, MS. (2004): Differentiate to thrive: lessons from the Legionella pneumophila life cycle. In: Mol. Microbiol. 53(1); 29–40, PMID 15225301; PDF (freier Volltextzugriff, engl.)
- ↑ Erickson, DL. et al. (2004): Pseudomonas aeruginosa relA contributes to virulence in Drosophila melanogaster. In: Infect. Immun. 72(10), 5638–5645, PMID 15385461; PDF (freier Volltextzugriff, engl.)
- ↑ Bugrysheva, JV. et al. (2005): Borrelia burgdorferi rel is responsible for generation of guanosine-3'-diphosphate-5'-triphosphate and growth control. In: Infect. Immun. 73(8), 4972–4981, PMID 16041012; PDF (freier Volltextzugriff, engl.)
- ↑ Haralalka, S. et al. (2003): Mutation in the relA gene of Vibrio cholerae affects in vitro and in vivo expression of virulence factors. In: J. Bacteriol. 185(16), 4672–4682, PMID 12896985; PDF (freier Volltextzugriff, engl.)
- ↑ Taylor, CM. et al. (2002): Listeria monocytogenes relA and hpt mutants are impaired in surface-attached growth and virulence. In: J. Bacteriol. 184(3), 621–628, PMID 11790730; PDF (freier Volltextzugriff, engl.)
- ↑ Dozot M, Boigegrain RA, Delrue RM, Hallez R, Ouahrani-Bettache S, Danese I, Letesson JJ, De Bolle X, Kohler S. The stringent response mediator Rsh is required for Brucella melitensis and Brucella suis virulence, and for expression of the type IV secretion system VirB. Cell. Microbiol. 2006 PMID 16803581
- ↑ Kim S, Watanabe K, Suzuki H, Watarai M. Roles of Brucella abortus SpoT in morphological differentiation and intramacrophagic replication. Microbiology. 151, 1607-1617, 2005 PMID 15870469
- ↑ Martinez-Costa OH, Arias P, Romero NM, Parro V, Mellado RP, Malpartida F. A relA/spoT homologous gene from Streptomyces coelicolor A3(2) controls antibiotic biosynthetic genes. J. Biol. Chem. 271, 10627-10634, 1996 PMID 8631867
- ↑ Moris M, Braeken K, Schoeters E, Verreth C, Beullens S, Vanderleyden J, Michiels J. Effective symbiosis between Rhizobium etli and Phaseolus vulgaris requires the alarmone ppGpp. J. Bacteriol. 187, 5460-5469, 2005 PMID 16030240
- ↑ Calderon-Flores A, Du Pont G, Huerta-Saquero, A, Merchant-Larios H, Servin-Gonzalez L, Duran S. The stringent response is required for amino acid and nitrate utilization, nod factor regulation, nodulation, and nitrogen fixation in Rhizobium etli. J. Bacteriol. 187, 5075-5083, 2005 PMID 16030199
- ↑ Takahashi K, Kasai K, Ochi K. Identification of the bacterial alarmone guanosine 5'-diphosphate 3'-diphosphate (ppGpp) in plants. Proc. Natl. Acad. Sci. USA, 101, 4320-4324, 2004 PMID 15010537
Wikimedia Foundation.