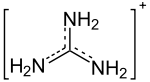
- Guanidin
-
Strukturformel 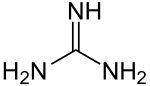
Allgemeines Name Guanidin Andere Namen - Iminoharnstoff
- Aminomethanamidin
- Carbamidin
Summenformel CH5N3 CAS-Nummer 113-00-8 Kurzbeschreibung farblose, hygroskopische Kristalle [1]
Eigenschaften Molare Masse 59,07 g·mol−1 Aggregatzustand fest
Schmelzpunkt Löslichkeit Sicherheitshinweise EU-Gefahrstoffkennzeichnung [2] keine Einstufung verfügbar R- und S-Sätze R: siehe oben S: siehe oben LD50 Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Guanidin ist eine organische Base (nicht zu verwechseln mit dem Nukleosid Guanosin). Guanidin kann man als Amidin der Carbamidsäure auffassen.
Inhaltsverzeichnis
Geschichte
Guanidin wurde erstmals 1861 durch oxidativen Abbau von Guanin synthetisiert.[4] Trotz seiner einfachen Molekülstruktur gelang die Aufklärung der Kristallstruktur erst 148 Jahre später.[5]
Vorkommen
Viele Naturstoffe sind Guanidinderivate, darunter so wichtige wie die proteinogene Aminosäure Arginin, das Kreatin und das Kreatinin. Die Guanidinderivate Arginin und Argininosuccinat spielen eine wichtige Rolle im Harnstoffzyklus und damit bei der Entgiftung des durch Stoffwechselprozesse gebildeten Ammoniaks.
Gewinnung und Darstellung
Es kann z. B. durch Schmelzen von Harnstoff oder Dicyandiamid mit Ammoniumnitrat hergestellt werden.
Chemische Eigenschaften
Die konjugierte Säure von Guanidin wird als Guanidinium-Kation bezeichnet. Aufgrund der mesomeriestabilisierenden Wirkung der drei Aminogruppen im Guanidinium-Kation [C(NH2)3]+ (durch Aufnahme eines H+) gehört Guanidin zu den stärksten organischen Basen, ähnlich stark wie ein Alkalihydroxid. Sein pKB-Wert beträgt 0,30.[6] Es bildet mit Säuren Guanidinum-Salze, z. B.
- Guanidiniumchlorid
- Guanidiniumthiocyanat
- Guanidiniumnitrat
- Guanindiniumcarbonat
Derivate
- Guanidin-Derivate werden zur Herstellung von Flammschutzmitteln und Harzen verwendet.
- Vom Guanidin leitet sich eine Reihe von Sprengstoffen ab, so z. B.:
- Guanidiniumnitrat
- Nitroguanidin
- Aminoguanidiniumnitrat
- Tetrazen
- Eine Reihe von Derivaten des Guanidins hat einen extrem süßen Geschmack, bis zur 200.000-fachen Süßkraft der Saccharose. Sie gehören damit zu den süßesten bisher bekannten Verbindungen.[7]
Einzelnachweise
- ↑ a b c Thieme Chemistry (Hrsg.): Römpp Online. Version 3.1. Georg Thieme Verlag, Stuttgart 2007.
- ↑ In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Guanidin bei ChemIDplus
- ↑ A. Strecker, Liebigs Ann. Chem. 1861, 118, 151.
- ↑ T. Yamada, X. Liu, U. Englert, H. Yamane, R. Dronskowski, Chem. Eur. J. 2009, 15, 5651.
- ↑ H. R. Christen, F. Vögtle: Organische Chemie - Von den Grundlagen zur Forschung. 2. Auflage, S. 425, Otto Salle Verlag, Frankfurt a. Main 1996, ISBN 3-7935-5398-1.
- ↑ H.-D. Belitz et al.: Lehrbuch der Lebensmittelchemie. 5. Aufl., Springer, Berlin u. a. 2001. S. 433.
Wikimedia Foundation.